
【题目】叠氮化钠(NaN3)是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①关闭止水夹K2,打开止水夹K1,开始制取氨气。
②加热装置A中的金属钠,使其熔化并充分反应后,停止通入氨气并关闭止水夹K1。
③向装置A中的b容器内充入加热介质,并加热到210~220℃,然后打开止水夹K2,制取并通入N2O。
请回答下列问题:
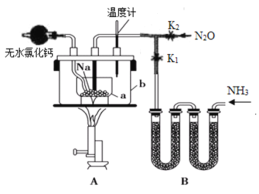
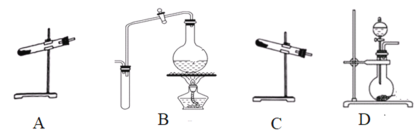
(1)制取氨气可选择的装置是__(填序号,下同),N2O可由NH4NO3在240~245℃分解制得(硝酸铵的熔点为169.6℃),则可选择的气体发生装置是__。
(2)步骤①中先通氨气的目的是__,步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为__,步骤③中最适宜的加热方式为___。
(3)生成NaN3的化学方程式为___。
(4)反应完全结束后,进行以下操作,得到NaN3固体:
a中混合物![]() NaN3固体
NaN3固体
已知NaNH2能与水反应生成NaOH和氨气。操作Ⅱ的目的是___,操作Ⅳ最好选用的试剂是___。
(5)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500g试样配成500.00mL溶液。②取50.00mL溶液置于锥形瓶中,加入50.00mL0.1010mol·L-1(NH4)2Ce(NO3)6溶液。③充分反应后,将溶液稍稀释,向溶液中加入8mL浓硫酸,滴入3滴邻菲啰啉指示剂,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑、Ce4++Fe2+=Ce3++Fe3+,试样中NaN3的质量分数为___。
【答案】BCD A 排尽装置中的空气 2Na+2NH3![]() 2NaNH2+H2 油浴加热 NaNH2+N2O
2NaNH2+H2 油浴加热 NaNH2+N2O![]() NaN3+H2O 降低NaN3的溶解度 乙醚 93.60%
NaN3+H2O 降低NaN3的溶解度 乙醚 93.60%
【解析】
(1)实验室可以选用氯化铵与消石灰共热或用浓氨水与新制生石灰(或氢氧化钠固体)或用浓氨水共热制备氨气,由于硝酸铵的熔点低于分解温度,所以用硝酸铵制备一氧化二氮时应防止硝酸铵熔化流出试管;
(2)金属钠具有很强的还原性,能与空气中的氧气反应,步骤①中应先通氨气的目的是用氨气排尽装置中的空气;步骤②的反应为氨气与熔化的钠反应生成氨基钠和氢气;步骤③为210~220℃条件下,氨基钠与一氧化二氮反应生成叠氮化钠和水;
(3)由题意可知,210~220℃条件下,氨基钠与一氧化二氮反应生成叠氮化钠和水;
(4)叠氮化钠固体微溶于乙醇,不溶于乙醚,操作Ⅱ加入乙醇可降低NaN3的溶解度,促使NaN3析出,操作Ⅳ选用乙醚,减少晶体的损失,有利于产品快速干燥;
(5)(NH4)2Ce(NO3)6的总的物质的量为0.1010mol/L×50×10-3L=0.00505 mol,部分与叠氮化钠反应,剩余的(NH4)2Ce(NO3)6用(NH4)2Fe(SO4)2标准溶液滴定,由此计算可得。
(1)实验室可以选用装置C用氯化铵与消石灰共热制备氨气,也可以选用装置D用浓氨水与新制生石灰(或氢氧化钠固体)反应快速制备氨气,还可以选用装置B用浓氨水共热制备氨气,则装置BCD均可以用于制备氨气;由于硝酸铵的熔点低于分解温度,所以用硝酸铵制备一氧化二氮时,为防止硝酸铵熔化流出试管,试管口应向上,则制备一氧化二氮的装置为A,故答案为:BCD;A;
(2)金属钠具有很强的还原性,能与空气中的氧气反应,则步骤①中先通氨气的目的是用氨气排尽装置中的空气,防止加热时空气中的氧气等能与钠反应;步骤②的反应为氨气与熔化的钠反应生成氨基钠和氢气,反应的化学方程式为2Na+2NH3![]() 2NaNH2+H2;步骤③为210~220℃条件下,氨基钠与一氧化二氮反应生成叠氮化钠和水,则最适宜的加热方式为油浴加热,故答案为:排尽装置中的空气;2Na+2NH3
2NaNH2+H2;步骤③为210~220℃条件下,氨基钠与一氧化二氮反应生成叠氮化钠和水,则最适宜的加热方式为油浴加热,故答案为:排尽装置中的空气;2Na+2NH3![]() 2NaNH2+H2;油浴加热;
2NaNH2+H2;油浴加热;
(3)由题意可知,210~220℃条件下,氨基钠与一氧化二氮反应生成叠氮化钠和水,反应的化学方程式为NaNH2+N2O![]() NaN3+H2O,故答案为:NaNH2+N2O
NaN3+H2O,故答案为:NaNH2+N2O![]() NaN3+H2O;
NaN3+H2O;
(4)由叠氮化钠固体易溶于水,微溶于乙醇,不溶于乙醚可知,操作Ⅱ加入乙醇的目的是可降低NaN3的溶解度,促使NaN3析出,操作Ⅳ最好选用乙醚,目的是减少晶体的溶解损失,且乙醚易挥发,有利于产品快速干燥,故答案为:降低NaN3的溶解度;乙醚;
(5)(NH4)2Ce(NO3)6的总的物质的量为0.1010mol/L×50×10-3L=0.00505 mol,部分与叠氮化钠反应,剩余的(NH4)2Ce(NO3)6用(NH4)2Fe(SO4)2标准溶液滴定,根据反应:Ce4++Fe2+===Ce3++Fe3+,参与反应的(NH4)2Ce(NO3)6与标准液的物质的量相等,则参与反应的(NH4)2Ce(NO3)6物质的量为0.050 0 mol/L×29.00×10-3L=0.001 45 mol,故与叠氮化钠反应的(NH4)2Ce(NO3)6有0.005 05 mol-0.001 45 mol=0.003 6 mol,根据反应方程式可得NaN3~(NH4)2Ce(NO3)6,则2.500 g试样中叠氮化钠的质量为0.003 6 mol×65 g/mol×![]() =2.34g,试样中NaN3的质量分数为
=2.34g,试样中NaN3的质量分数为![]() ×100%=93.60%,故答案为:93.60%。
×100%=93.60%,故答案为:93.60%。


科目:高中化学 来源: 题型:
【题目】25 ℃时,几种弱酸的电离常数如下:
弱酸的化学式 | CH3COOH | HCN | H2S |
电离常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
25 ℃时,下列说法正确的是
A.等物质的量浓度的各溶液的pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度的HCN溶液的pH=d,则其中c(OH-)=10-d mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某晶体 M·nH2O溶于水后,溶液温度降低。而 M(s)溶于水后,溶液温度升高,可将变化过程表示为图。下列说法中错误的是( )
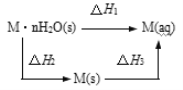
A.△H1=△H2+△H3
B.M(s)溶于水形成溶液△S>0
C.△H2>△H3
D.△H1+△H3>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组性质比较中,正确的是()
①沸点:![]()
②离子还原性:![]()
③酸性:![]()
④金属性:![]()
⑤气态氢化物稳定性:![]()
⑥半径:![]()
A.①②③B.③④⑤⑥C.②③④D.①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用传感技术可以探究压强对2NO2(g)![]() N2O4(g)化学平衡移动的影响。在室温、100kPa条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列说法正确的是( )
N2O4(g)化学平衡移动的影响。在室温、100kPa条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列说法正确的是( )
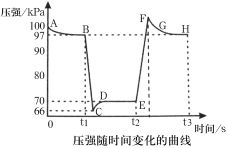
A.B点处NO2的转化率为3%
B.E点到H点的过程中,NO2的物质的量先增大后减小
C.E、H两点对应的正反应速率大小为vH>vE
D.B、E两点气体的平均相对分子质量大小为MB>ME
查看答案和解析>>
科目:高中化学 来源: 题型:
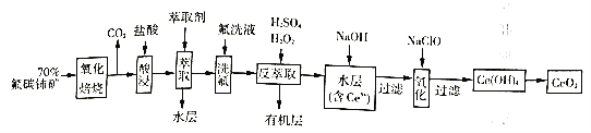
【题目】二氧化铈(![]() )是一种重要的稀土化合物。以氟碳铈矿(主要含
)是一种重要的稀土化合物。以氟碳铈矿(主要含![]() )为原料制备
)为原料制备![]() 的一种工艺流程如图:
的一种工艺流程如图:
已知:①![]() 能与
能与![]() 结合成
结合成![]() ,也能与
,也能与![]() 结合成
结合成![]() ;②
;②![]() 在硫酸体系中能被萃取剂
在硫酸体系中能被萃取剂![]() 萃取,而
萃取,而![]() 不能。回答:
不能。回答:
(1)“氧化培烧”前需将矿石粉碎成细颗粒,其目的是_________。
(2)“酸浸”中会产生大量黄绿色气体,写出![]() 与盐酸反应的离子方程式:____________;为避免产生上述污染,解决方案为__________。
与盐酸反应的离子方程式:____________;为避免产生上述污染,解决方案为__________。
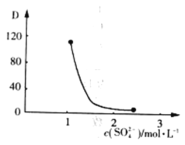
(3)“萃取”时存在反应:![]() 。实验室中萃取时要用到的主要玻璃仪器名称为__________;图中D是分配比,表示
。实验室中萃取时要用到的主要玻璃仪器名称为__________;图中D是分配比,表示![]() (Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比
(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比![]() 。保持其它条件不变,在起始料液中加入不同量的
。保持其它条件不变,在起始料液中加入不同量的![]() 以改变水层中的
以改变水层中的![]() ,D随起始料液中
,D随起始料液中![]() 变化的原因:_____________。在
变化的原因:_____________。在![]() 的条件下,取
的条件下,取![]() 含四价铈总浓度为
含四价铈总浓度为![]() 的酸浸液,向其中加入
的酸浸液,向其中加入![]() 萃取剂
萃取剂![]() ,充分振荡,静置,水层中
,充分振荡,静置,水层中![]() _________。(结果保留二位有效数字)。
_________。(结果保留二位有效数字)。
(4)“反萃取”中,在稀硫酸和![]() 的作用下
的作用下![]() 转化为
转化为![]() 。
。![]() 在该反应中作用与下列反应中
在该反应中作用与下列反应中![]() 的作用相同的是________。
的作用相同的是________。
A.![]() 处理含酸性重铬酸钾的废水
处理含酸性重铬酸钾的废水
B.![]() 和二氧化锰混合制氧气
和二氧化锰混合制氧气
C.![]() 与氧化钙制过氧化钙
与氧化钙制过氧化钙
D.![]() 在海带提碘实验中的作用
在海带提碘实验中的作用
(5)“氧化”步骤的化学方程式为:___________。
(6)取上述流程中得到的![]() 产品
产品![]() ,加硫酸溶解后,用
,加硫酸溶解后,用![]() 溶液滴定至终点时(铈被还原为
溶液滴定至终点时(铈被还原为![]() ,其他杂质均不反应,
,其他杂质均不反应,![]() 为无色),用
为无色),用![]() 标准酸性
标准酸性![]() 溶液滴定过量的
溶液滴定过量的![]() ,消耗
,消耗![]() 标准溶液。该产品中
标准溶液。该产品中![]() 的质量分数为________。
的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W,已知X的某种氢化物可使溴的四氯化碳溶液褪色,X原子电子占据2个电子层;Y广泛作电池材料且单位质量的金属提供电子数目最多;实验室可用Z的氢化物的浓溶液和![]() 固体在常温下制备Z的单质;向含W元素的含氧酸钠盐溶液中通入X的氧化物,观察到沉淀质量(m)与X的氧化物体积(V)关系如图所示。下列说法正确的是( )
固体在常温下制备Z的单质;向含W元素的含氧酸钠盐溶液中通入X的氧化物,观察到沉淀质量(m)与X的氧化物体积(V)关系如图所示。下列说法正确的是( )
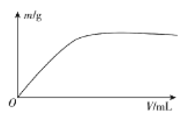
A.Y的单质在空气中燃烧生成过氧化物和氮化物
B.X的含氧酸的酸性可能比Z的含氧酸的酸性强
C.Z和W组成的化合物一定是非电解质
D.X、Z、W原子半径的大小不能比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.23 g Na与足量H2O反应完全后可生成NA个H2分子
B.1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子
C.标准状况下,22.4 L Cl2含NA个原子
D.3 mol单质Fe完全转变为Fe3O4,失去8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍 | 试通过计算填空: (1)A的相对分子质量为__。 |
将9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为__。 |
另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团__、__。 |
A的核磁共振氢谱如图:
| (4)A中含有__种氢原子。 综上所述,A的结构简式为__。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com