
| A、是否为大量分子或离子的集合体 |
| B、分散质微粒直径的大小 |
| C、是否能通过滤纸或有丁达尔现象 |
| D、是否均一、稳定、透明 |
科目:高中化学 来源: 题型:
| A、2.24L | B、0.2mol |
| C、7.1g | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、③④ |
| C、①③④ | D、①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
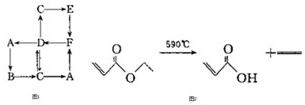
查看答案和解析>>
科目:高中化学 来源: 题型:
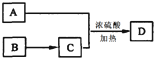
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O,下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O,下列有关说法正确的是( )| A、K与N相接时,电解池密度增大 |
| B、K与N相接时,H+向负极区迁移 |
| C、K与M连接时,所用电源的b极为负极 |
| D、K与M相接时,阳极附近的pH逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
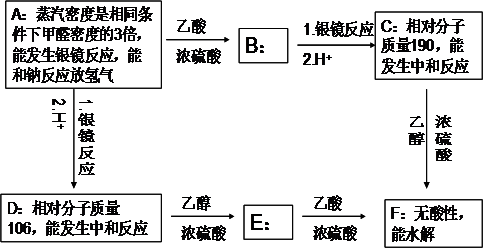
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(HCOOH) |
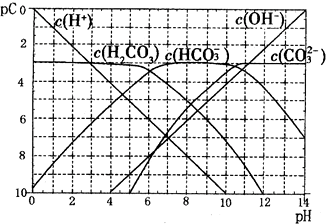
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com