

- 4 |
- 2 |
 ═□Mn2++□NO
═□Mn2++□NO- 3 |
| n |
| V |
 ,
, ;
;| 7.9g |
| 158g/mol |
| 10 |
| 100 |
| 5 |
| 2 |
| 0.0125mol |
| 0.02L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 |
(用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:
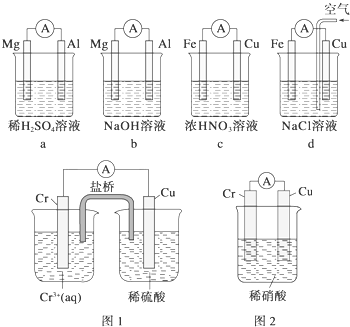 (1)分析如图所示的四个装置,回答下列问题:
(1)分析如图所示的四个装置,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
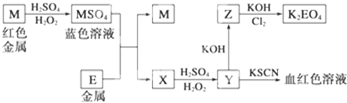
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| B、氯化亚铁溶液与过氧化钠2:1反应:6Fe2++3Na2O2+6H2O═4Fe(OH)3↓+6Na++2Fe3+ |
| C、向氧化铁中加入氢碘酸发生反应:Fe2O3+6HI═2Fe2++I2+3H2O+4I- |
| D、过量铁粉与稀HNO3反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蓄电池放电时,每消耗0.1molPb,共生成0.1molPbSO4 |
| B、电解池的阴极反应式为:2H++2e-=H2↑ |
| C、电解过程中溶液中会产生白色沉淀现象 |
| D、蓄电池中每生成1molH2O,电解池中就消耗1molH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、XY |
| B、XY2 |
| C、XY3 |
| D、XY4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com