
| A. | 乙二醇和丙三醇是1:1 | B. | 乙醇和乙二醇是1:2 | ||
| C. | 甲醇和乙醇是5:1 | D. | 甲醇和乙醇是4:1 |
分析 根据n=$\frac{V}{{V}_{m}}$计算出氢气的物质的量,再根据羟基与氢气的关系式计算出醇中含有羟基的物质的量;A、B中分别设出两种醇的物质的量,根据体题中数据验证即可;C、D计算出醇的平均摩尔质量,然后根据平均摩尔质量计算出甲醇和乙醇的物质的量之比即可.
解答 解:标准状况下1.344L氢气的物质的量为:$\frac{1.344L}{22.4L/mol}$=0.06mol,根据关系式2-OH~H2可知,醇中含有羟基的物质的量为:0.06mol×2=0.12mol,
若为乙二醇和丙三醇,设乙二醇为xmol、丙三醇为ymol,则:2x+3y=0.12,当乙二醇和丙三醇是1:1时,x=y,则解得x=y=0.024,二者的总质量为:62g/mol×0.024mol+92g/mol×0.024mol=3.696g<4.176g,故A错误;
若为乙醇和乙二醇,设乙醇为xmol、乙二醇为ymol,x+2y=0.12mol,当乙醇和乙二醇是1:2时,即:x=2y,带人解得:y=0.03mol,则混合物中含有0.06mol乙醇和0.03mol乙二醇,总质量为:46g/mol×0.06mol+62g/mol×0.03=4.62g>4.176g,故B错误;
甲醇和乙醇为一元醇,根据关系式2-OH~H2可知,醇的物质的量为:0.06mol×2=0.12mol,醇的平均摩尔质量为:$\frac{4.176g}{0.12mol}$=34.8,设甲醇为xmol、乙醇为ymol,则$\frac{32x+46y}{x+y}$=34.8,整理可得:x:y=4:1,故C错误、D正确,
故选D.
点评 本题考查了混合物反应的计算,题目难度较大,注意掌握平均摩尔质量的计算及应用方法,试题计算量较大,充分考查了学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | abc 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | |||
| A. | 当pH<4时,碳钢主要发生析氢腐蚀 | |
| B. | 当pH>6时,碳钢主要发生吸氧腐蚀 | |
| C. | 当pH>14时,正极反应为O2+4H++4e→2H2O | |
| D. | 在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
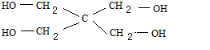 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LCCl4中含Cl原子数目为0.4NA | |
| B. | 白磷分子(P4)呈正四面体结构,12.4 g白磷中含有P-P键数目为0.6NA | |
| C. | 5.6 g铁粉在2.24l(标准状况)氯气中充分燃烧,失去的电子数为0.3NA | |
| D. | 常温常压下,10 g46%酒精水溶液中含氧原子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 操作 | 现象 | 结论 |
| A | 向FeSO4溶液中滴入少量酸性KMnO4溶液 | KMnO4溶液紫色褪去 | Fe2+有氧化性 |
| B | 向Na2SiO3溶液中通入适量的CO2 | 产生白色胶状物质 | 酸性:H2CO3>H2SiO3 |
| C | 将新制氯水和NaBr溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液呈橙红色 | 氧化性:Cl2>Br2 |
| D | 向Al2(SO4)3溶液中滴加过量氨水 | 溶液先浑浊后澄清 | Al3+与NH3•H2O不能大量共存 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3只发生氧化反应 | B. | 反应消耗12g C时电子转移5mol | ||
| C. | 还原产物只有K2S和 N2 | D. | 被氧化与被还原的S为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32g O2和16g O3的混合物中,含有O原子数目为2NA | |
| B. | 标准状况下,1mol Na2O 和1mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1mol NaHSO4溶于水或受热熔化,电离出来的离子数目均为2NA | |
| D. | 在K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O中,若生成71g Cl2,转移的电子数目为 $\frac{2}{3}$NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com