
 Q、R、X、Y、Z、W为周期表中原子序数依次递增的前四周期元素.
Q、R、X、Y、Z、W为周期表中原子序数依次递增的前四周期元素.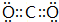 ,分子的空间构型是直线形;Z3+的原子结构示意图为
,分子的空间构型是直线形;Z3+的原子结构示意图为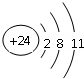 ;X2Q4分子中X原子的杂化方式为sp3杂化.
;X2Q4分子中X原子的杂化方式为sp3杂化.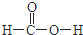 ,m g该物质完全燃烧后通过足量Na2O2固体充分吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g
,m g该物质完全燃烧后通过足量Na2O2固体充分吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g分析 Q、R、X、Y、Z、W为周期表中原子序数依次递增的前四周期元素,已知:①Q为元素周期表中原子半径最小的元素,则Q为H元素;②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子排布为1s22s22p2,则R为C元素;③Y的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,应为O元素;④Z基态原子有六个未成对电子,只能处于第四周期,外围电子排布式为3d54s1,则Z为Cr元素;⑤W+离子的核外M能层中电子全充满,原子质子数为2+8+18+1=29,则W为Cu;结合原子序数可知,X为N元素,据此解答.
解答 解:Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素,已知:①Q为元素周期表中原子半径最小的元素,则Q为H元素;②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子排布为1s22s22p2,则R为C元素;③Y的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,应为O元素;④Z基态原子有六个未成对电子,只能处于第四周期,外围电子排布式为3d54s1,则Z为Cr元素;⑤W+离子的核外M能层中电子全充满,原子质子数为2+8+18+1=29,则W为Cu;结合原子序数可知,X为N元素.
(1)R、X、Y三种元素的分别为C、N、O,同周期元素从左到右元素的第一电离能呈增大趋势,则C元素的最小,但N原子的电子排布中2p轨道为半满稳定状态,能量较低,则失去1个电子更难,第一电离能高于O元素,故第一电离能N>O>C,
故答案为:N>O>C;
(2)Q为H元素,元素在元素周期表中属于s区,Y为O元素,与之同族的第四周期元素的价电子排布式为4s24p4,
故答案为:s;4s24p4;
(3)CO2的电子式为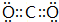 ,分子的空间构型是直线形,Cr3+的原子结构示意图为
,分子的空间构型是直线形,Cr3+的原子结构示意图为 ,N2H4分子中N原子形成3个单键、含有1对孤对电子,杂化轨道数目为4,杂化方式为sp3杂化,
,N2H4分子中N原子形成3个单键、含有1对孤对电子,杂化轨道数目为4,杂化方式为sp3杂化,
故答案为: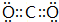 ;直线形;
;直线形; ;sp3杂化;
;sp3杂化;
(4)CH2O2的结构式为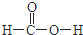 ,燃烧生成二氧化碳与水,再通过过氧化钠反应生成碳酸钠与氢氧化钠,固体增重相当于为CO、H2质量,CH2O2可以改写为CO.H2.O,Na2O2固体增重的质量为mg×$\frac{30}{46}$=$\frac{15m}{23}$g,
,燃烧生成二氧化碳与水,再通过过氧化钠反应生成碳酸钠与氢氧化钠,固体增重相当于为CO、H2质量,CH2O2可以改写为CO.H2.O,Na2O2固体增重的质量为mg×$\frac{30}{46}$=$\frac{15m}{23}$g,
故答案为: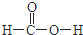 ;$\frac{15m}{23}$;
;$\frac{15m}{23}$;
(5)由Y、Z两种元素组成的Cr2O72-离子在酸性条件下可与乙醇反应,生成乙酸、Cr3+等物质.该反应的离子方程式为:2Cr2O72-+3CH3CH2OH+16H+═4Cr3++3CH3COOH+11H2O,
故答案为:2Cr2O72-+3CH3CH2OH+16H+═4Cr3++3CH3COOH+11H2O;
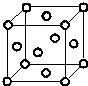
(6)该晶胞为面心立方密堆积,以顶点原子研究,与之距离最近原子处于面心,在该晶体中每个W原子周围距离最近的W原子数目为$\frac{3×8}{2}$=12,晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{64}{{N}_{A}}$g,W原子半径为r pm,则晶胞边长为4r pm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$r pm,则该晶体的密度为4×$\frac{64}{{N}_{A}}$g÷(2$\sqrt{2}$r×10-10 cm)3=$\frac{256}{{N}_{A}×(2\sqrt{2}r×1{0}^{-10})^{3}}$g.cm-3,
故答案为:12;$\frac{256}{{N}_{A}×(2\sqrt{2}r×1{0}^{-10})^{3}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、杂化方式判断、化学计算、晶胞结构与计算等,推断元素是解题关键,注意理解同周期元素中第一电离能异常情况,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子数:17gOH-与1mol-OH | |
| B. | 双键数目:1mol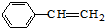 与4mol C2H4 与4mol C2H4 | |
| C. | 分子数:常温常压下16g氧气与4g氦气 | |
| D. | 阴离子总数:72gCaO2与62g Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
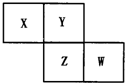 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | Z的单质与氢气反应较Y剧烈 | |
| B. | X、Y形成的化合物都易溶于水 | |
| C. | 只由这四种元素不能组成有机化合物 | |
| D. | 最高价氧化物对应水化物的酸性W比Z弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
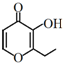 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | lmol该有机物最多能与2molH2发生加成反应 | |
| B. | 该有机物的分子式为C7H8O3 | |
| C. | 该有机物能发生取代反应、加成反应、消去反应和氧化反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g Na在化学反应中失去的电子数目为NA | |
| B. | 17g NH3中所含原子数为4NA | |
| C. | 常温常压下,11.2 LSO3含有的氧原子数为1.5NA | |
| D. | 标准状况下,分子数目为NA氯气所占的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Cu | Cu2O | CuO | Cu(OH)2 | CuSO4•5H2O |
| 红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③ | C. | ①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明溶液中:Al3+、Ca2+、Cl-、HCO3- | |
| B. | 含大量Fe3+的溶液中:K+、I-、SO42-、NO3- | |
| C. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、SO32- | |
| D. | 由水电离出的c(H+)=1.0×10-14mol/L的溶液中:Mg2+、K+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com