
����Ŀ���±�ΪԪ�����ڱ���һ������Ԫ�ط��Ż�ѧʽ�ش��������⡣
���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | ||||
4 | �� | �� |
��1��д��������Ԫ����ɵķ��ӵĵ���ʽ��_______��
��2��������̬�⻯���������������ˮ���ﷴӦ�ķ���ʽΪ , ���������г���Ԫ���������Ӱ뾶��С���� �������ӷ��ţ���
��3���ڢۢ�����Ԫ������������Ӧ��ˮ���������ǿ���� (�ѧʽ)��Ԫ�������⻯��ĽṹʽΪ �� ���⻯���Ԫ�������ʷ�Ӧ�Ļ�ѧ����ʽΪ ��
��4��Ԫ�����ĵ������ڢ��γɵĻ��������Һ��Ӧ�����ӷ���ʽΪ ���ڷ�Ӧ�����Һ�м����л��ܼ��������õ�ʵ������Ϊ ��
��5������ͬ���壬�������ڵ�Ԫ�ص��������ĵ�����ȼ�����ɵĻ�����ĵ���ʽ ���ܢ��Ԫ�ص����ӵĻ�ԭ����ǿ����˳��Ϊ �������ӷ��ţ���
���𰸡���1��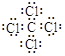 ��2��NH3+ HNO3= NH4NO3Al3+
��2��NH3+ HNO3= NH4NO3Al3+
��3��KOH H��O��H 2F2+ 2H2O =" 4HF" + O2
��4��Cl2+2Br����2 Cl��+Br2 ��Һ�ֲ㣬�ϲ�Ϊ�Ⱥ�ɫ���²�Ϊ��ɫ
��5��![]() Br����Cl����F��
Br����Cl����F��
���������������������Ԫ�������ڱ��е�λ�ÿ�֪��������Ԫ�طֱ�ΪN��K��Mg��F��Al��C��O��Cl��Br��Ar��
��1�����������������������ֱ�ΪC��Cl�γɹ��ۻ�����CCl4������ʽΪ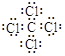 ��
��
��2��������̬�⻯��ΪNH3��N������������ˮ����ΪHNO3�����߷�Ӧ��������泥���Ӧ�ķ���ʽΪNH3+ HNO3= NH4NO3, ͬ����Ԫ�ص������ӵĵ��Ӳ�������������ͬ�������ӵĵ��Ӳ����뱾������ͬ���ҵ��Ӳ�����ͬ�����ӣ��˵����Խ�뾶ԽС������������г���Ԫ���������Ӱ뾶��С����Al3����
��3���ڢۢ�Ԫ�طֱ�ΪK��Mg��Al��Ԫ�صĽ�����Խǿ������������ˮ�������Խǿ�������ԣ�K>Mg>Al������Ԫ������������Ӧ��ˮ���������ǿ����KOH��Ԫ�������⻯��ΪH2O��ˮ�ǹ��ۻ����ˮ�ĽṹʽΪH��O��H�� ˮ��F2���ҷ�Ӧ����HF����������Ӧ�Ļ�ѧ����ʽΪ2F2+ 2H2O =" 4HF" + O2��
��4��Ԫ�����ĵ������������ڢ��γɵĻ�����ΪKBr�������������Դ���Br2��������KBr�����ǽ������ʼ���û���Ӧ����Ӧ�����ӷ���ʽΪCl2+2Br����2 Cl��+Br2 ��Br2�������л��ܼ������ڱ��гʳȺ�ɫ������ˮ�������ܣ������ڷ�Ӧ�����Һ�м����л��ܼ��������õ�ʵ������Ϊ��Һ�ֲ㣬�ϲ�Ϊ�Ⱥ�ɫ���²�Ϊ��ɫ��
��5����ΪK����4���ڣ�����A�壬��Kͬ���壬�������ڵ�Ԫ�ص���ΪNa�����ĵ�����������Na��������ȼ�յ�������ΪNa2O2��Na2O2�ĵ���ʽΪ![]() ���ܢ��Ԫ�ص����ӷֱ�ΪF����Cl����Br�������ǵ�Ԫ������ͬ���壬��ͬ����Ԫ����˵�����ϵ��£��ǽ����Լ��������ʵ������Լ�������Ӧ���ӵĻ�ԭ��������ǿ����ԭ����ǿ����˳��ΪBr����Cl����F����
���ܢ��Ԫ�ص����ӷֱ�ΪF����Cl����Br�������ǵ�Ԫ������ͬ���壬��ͬ����Ԫ����˵�����ϵ��£��ǽ����Լ��������ʵ������Լ�������Ӧ���ӵĻ�ԭ��������ǿ����ԭ����ǿ����˳��ΪBr����Cl����F����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˾ƥ�ֿڷ�ʱ�����н�����ʹ���á���һ�ֳ��õ����Ƹ�ð��ҩ�Ҳ�����ڿ���ʪ���ٽ�ʹ�综���������й�������������ְ�˾ƥ��������ѪС�����ۣ��ɷ�ֹѪ˨�����ɡ�������Ч�ɷ�������ˮ���ᣨ ����ʵ������ˮ���ᣨ���ǻ������ᣩ���������(CH3CO)2O��Ϊ��Ҫԭ�Ϻϳ�����ˮ���ᡣ
����ʵ������ˮ���ᣨ���ǻ������ᣩ���������(CH3CO)2O��Ϊ��Ҫԭ�Ϻϳ�����ˮ���ᡣ
����Ӧԭ��������װ�á�

��ʵ�����̡�

��֪������������ˮ�ֽ����ɴ��ᡣ
��ˮ���������ˮ���������ˮ����������������ˮ��������Ϊ�߷��ӻ����������ˮ��
�ش��������⣺
��1���ϳɹ�����Ҫ�����¶���85�桫90�棬����ʵļ��ȷ��� ��
��2����ͼ1װ�ù��˱���ͨ©�����˵��ŵ��� ��
��3���ֲ�Ʒ�ᴿ��
�ٷ�������������NaHCO3��Һ�ܽ�ֲ�Ʒ��Ŀ���� ���жϸù��̽����������� ��
�ڼ�Ũ���ᡢ��ȴ��IJ�����__________��______��������ء�������ʡ�
�۴��ȼ��飺ȡ������Ʒ����ʢ��2 mLˮ���Թ��У�����1��2��FeCl3��Һ����Һ��dz��ɫ�����ܵ�ԭ���� ��
��4����˾ƥ��ҩƬ������ˮ���Ậ���IJⶨ���裨�ٶ�ֻ������ˮ������ϣ����ϲ����뷴Ӧ����
������ȡ��˾ƥ����Ʒmg��
��������Ʒ���飬����V1 mL a mol/LNaOH�������������ȣ���ȥ���ϵȲ������������Һ������ƿ��
��������ƿ�еμӼ��μ��ȣ���Ũ��Ϊb mol/L�ı�����ζ�ʣ���NaOH��������������ΪV2 mL��
��֪������ˮ���������NaOH��Һ���ȷ�����Ӧ�Ļ�ѧ����ʽ��

��˾ƥ��ҩƬ������ˮ�������������ı���ʽΪ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��D��E��FΪ������Ԫ�أ��ǽ���Ԫ��A����������������������ͬ��B����������������������������2����B�ĵ�����D�ĵ����г��ȼ������������ۻ�����BD2��E����D2��������ͬ�ĵ�������A�ĵ�����F�ĵ�����ȼ�հ��в�ɫ���棬��������ˮ�õ�һ��ǿ�ᡣ�ش��������⣺
��1��F��Ԫ�ط���Ϊ___________________________��
��2��A�����ڱ��е�λ���� ��
��3��A��D��Ӧʱ�������γ�ԭ��أ���ԭ��صĸ����Ϸ���������Ӧ��������________��
��4��B��D��E��ɵ�һ�����У�E����������ΪԼ43%��������Ϊ ��
��5��E��D��ȼ�ղ���ĵ���ʽΪ____________________________________��
��6��A��E�����γ����ӻ�����û�������ˮ��Ӧ�ķ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ�Ӻ�������Ų�ʱ��������K��L��M����ʾ��һ�㡢�ڶ��㡢�����㣻AԪ��ԭ��M���Ӳ�����3�����ӣ�BԪ����AԪ�ص�ԭ�Ӻ�����Ӳ�����ͬ��BԪ�ص�ԭ������������Ϊ1��CԪ�ص�ԭ�ӱ�BԪ��ԭ����4�����ӡ�
��1��BԪ�ص�ԭ�ӽṹʾ��ͼΪ ��
��2��AԪ�������ڱ��е�λ�� ��
��3������BԪ�صĻ���������ɫ����������ʱ����� ɫ��
��4��A��B������������ˮ�������Ӧ�����ӷ���ʽΪ�� ��
��5��CԪ�ص��������ж��֣�������ɫΪ����ɫ�������������������ѧʽ��
��6��A��B��ȣ�A�Ľ�������������B�Ľ����ԣ�����ǿ����������������
��7��A�ĵ���������������������NaOH��Һ��Ӧ����������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ѧ����������ίԱ����ȷ����116��Ԫ��Lv������Ϊ�W������![]() Lv�������������
Lv�������������
A. ԭ������116 B. ������177 C. ���������116 D. ���ԭ������293
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NO2��N2O4�ת����2NO2��g��![]() N2O4��g������H=��24.2kJ/mol���ں����£���һ����NO2��N2O4��g���Ļ������������Ϊ2L���ܱ������У��������ʵ�Ũ����ʱ��仯�Ĺ�ϵ��ͼ���������������������ǣ� ��
N2O4��g������H=��24.2kJ/mol���ں����£���һ����NO2��N2O4��g���Ļ������������Ϊ2L���ܱ������У��������ʵ�Ũ����ʱ��仯�Ĺ�ϵ��ͼ���������������������ǣ� ��
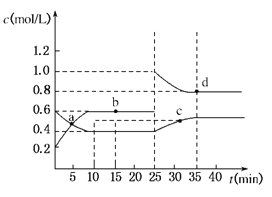
A��a��b��c��d�ĵ���V����V�������
B����Ӧ���е�10minʱ����ϵ���յ�����Ϊ9.68kJ
C��ǰ10min�ڣ���v��NO2����ʾ�ĸ÷�Ӧ����Ϊ0.02mol/Lmin
D��25minʱ������ƽ���ƶ���ԭ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����N��B��Ԫ����ɵ����Ͳ������Ź㷺��;��
��1��B2H6��һ�ָ���ȼ�ϣ�����Cl2��Ӧ���ɵ�BCl3�����ڰ뵼����ӹ��ռ��ߴ������죬�ɵڶ�����Ԫ����ɵ���BCl3��Ϊ�ȵ������������Ϊ_________(�����ӷ��ţ���һ��)��
��2�������黯����(H2N��BH2)��Ti(BH4)3��Ϊ���ܹ�ע�����ͻ�ѧ�����ﴢ����ϡ�
��H2N��BH2��Nԭ�ӵ��ӻ�����Ϊ_________��
��Ti(BH4)3��TiCl3��LiBH4��Ӧ�Ƶá���̬Ti3+��δ�ɶԵ�������____����BH4-�����幹����_________��д�����Ʊ���Ӧ�Ļ�ѧ����ʽ_________��
�������������Ԫ��״������(HB=NH)3ͨ����������Ӧ�Ƶã�
3CH4+2(HB=NH)3+6H2O�T3CO2+6H3BNH3��������ѧ����ʽ�йص���������ȷ����_________����(����)
A���������д�����λ��
B����һ�����ܣ�N��O��C��B
C����Ӧǰ��̼ԭ�ӵĹ���ӻ����Ͳ���
D��CH4��H2O��CO2���ӿռ乹�ͷֱ��ǣ����������Ρ�V�Ρ�ֱ����
��3������(BP)���ܵ��߶ȹ�ע�����O���ϣ���ͼ1Ϊ������
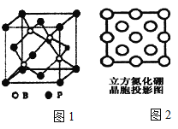
������������________����(�������)��________(���ǻ��)������λ����
��������Bԭ�ӵ���λ��Ϊ_______��
��4��������������һ�����͵ij�Ӳ�����O�����µĽṹ���ϣ���ṹ��Ӳ�ȶ�����ʯ���ƣ����۵�Ƚ��ʯ�ͣ�ԭ����________��ͼ2��������������z���ͶӰͼ������ͼ��Բ����Ϳ���ͻ��������ֱ����B��N�����λ�á�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ����ú�ˮ��Դ��һ����Ҫ���о����⣬�����ǹ�ҵ���ú�ˮ�Ʊ�ʳ�Ρ��������þ�����ʵ�һ�����̣�

����������
��1������Y�� (�ѧʽ)����ҺII�з�����Ӧ�Ļ�ѧ����ʽ�ǣ� ��ʵ���ҿ�����ͼװ��ģ����Ʊ����̣�����c������ ����Ӧʱa��Ӧͨ�� ��

��2��Ϊ�˲ⶨ̼��������������Ԫ�صĺ������ȳ�ȡa g����������ˮ�ܽ⣬��������ϡ�����ữ�����100 mL��Һ��ȡ��20 mLע����ƿ�У�Ȼ����c mol/LAgNO3����Һ�ζ�Cl����K2CrO4��ҺΪָʾ������֪��������Ksp(AgCl)��2��10��10 ��Ksp(Ag2CrO4)��1.12��10��12 ��Ag2CrO4Ϊש��ɫ��
�ٵ�Cl��ǡ�ó�����ȫ����Һ�в���c(Cl��)��1.0��10��5 mol��L��1�����ʱ��Һ�е�c(CrO42-)�� mol��L��1��
�ڵζ������У�ʹ����ɫ�ζ��ܵ�ԭ���� �����۲쵽���� ʱֹͣ�ζ�������ʱ������AgNO3����Һv mL����̼��������Ʒ��������Ԫ�ص�������������ʽΪ ��
��������������ʵ��ⶨ���ƫ�͵��� ��
a��ʢ��AgNO3��Һ�ĵζ���ˮϴ��δ�ñ�Һ��ϴ
b���ζ��ܵζ�ǰ���첿�������ݣ��ζ�����ʧ
c���ζ�ǰ���Ӷ������ζ����Ӷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A����ͨ����ͬ�ķ�Ӧ�õ�B��C:
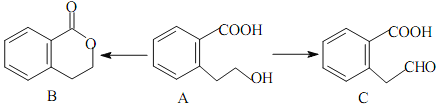
��1��A�ķ���ʽΪ_________________��C�ĺ�������������Ϊ_________________��
��2��A��ȡC���л���Ӧ����Ϊ_________________��A��ȡB�Ļ�ѧ����ʽΪ��_________________��
��3��A������ȥ��Ӧ�����Ľṹ��ʽΪ_________________��A������һ�������̼ԭ����_________________����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com