
| A、①③ | B、②④ | C、②③ | D、③④ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其核内中子数112 |
| B、其原子质量是12C的277倍 |
| C、其核内中子数与质子数之差为53 |
| D、其原子核外的电子数为277 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用过量氨水吸收工业尾气中的SO2:2NH3?H2O+SO2=2NH4++SO32-+H2O |
| B、Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+4H2O |
| C、磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| D、明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性氧化物 氧化铁 FeO |
| B、酸性氧化物 碳酸气 CO |
| C、酸 硫酸 H2SO3 |
| D、盐 纯碱 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CH3COOH)>c(CH3COO-) |
| B、c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH)+c(OH-) |
| C、c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、c(CH3COO-)+c(CH3COOH)=0.02 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将氨水逐滴滴入AgNO3溶液中,至过量 |
| B、将二氧化碳通入Ca(OH)2 溶液中,至过量 |
| C、将氯气通入AgNO3溶液中好,至过量 |
| D、将二氧化氮通入Ba(OH)2 溶液中,至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
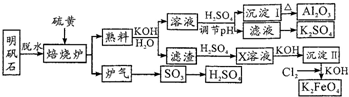
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com