
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO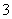 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是( )
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是( )
A.Cl2和苛性钾溶液在不同温度下可能发生不同反应
B.反应中转移电子数为是0.21 NA
C.原苛性钾溶液中KOH的物质的量无法确定
D.生成物中Cl- 的物质的量为 0.21 mol
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
对于反应A(g)+B(g)3C(g)(正反应为放热反应),下述为平衡状态标志的是( )
①单位时间内A、B生成C的分子数与C分解的分子数相等 ②外界条件不变时,A、B、C浓度不随时间变化 ③体系温度不再变化 ④体系的压强不再变化 ⑤体系的分子总数不再变化
A.①② B.①②③
C.①②③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
已知,N2 (g) + 3H2(g) 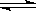 2NH3(g) △H=-92.4 kJ·mol-1 。在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) △H=-92.4 kJ·mol-1 。在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol·L | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 |
|
|
|
下列说法正确的是
A.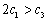 B.
B.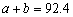 C.
C.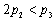 D.α1 +α2 > 1
D.α1 +α2 > 1
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480 mL含 NaClO 25%,密度为1.19 g/cm3的消毒液。下列说法正确的是( )
A.定容摇匀后,有少量溶液外流,则NaClO的物质的量浓度偏小
B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C.所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小
D.需要称量的NaClO固体的质量为142.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
在Al2(SO4)3和(NH4)2SO4的混合溶液中,逐滴加入NaOH溶液至过量。下列图示能正确表示生成沉淀的质量与滴入NaOH溶液体积关系的是( )
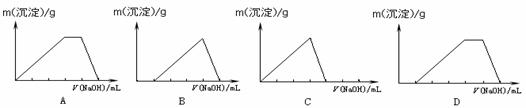
查看答案和解析>>
科目:高中化学 来源: 题型:
2014年5月中美科学家研究发现,常温下氢气分子可以在碳纳米管内与水形成氢气水合物,其原理类似于可燃冰的形成,这项研究有望能洁净安全地储存氢气。下列说法正确的是
A.碳纳米管以水合物储存氢气属化学变化
B.碳纳米管与金刚石互为同素异形体
C.氢气水合物与可燃冰是同一物质
D.氢气与纳米管内的水分子形成共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
图示中的四种物质W、X、Y、Z,能按箭头方向一步转化的有
| W | X | Y | Z |
| |
| ① | Na | NaOH | Na2CO3 | NaCl | |
| ② | Al(OH)3 | Al2O3 | Al | NaAlO2 | |
| ③ | SO2 | (NH4)2SO3 | NH4HSO3 | Na2SO3 | |
| ④ | FeCl2 | Fe | FeSO4 | FeCl3 |
A.①②③④ B.①②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表。
| 化合物 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(一)乙酸正丁酯的制备
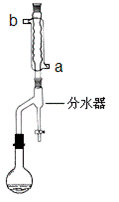
①在干燥的50mL圆底烧瓶中,加入13.5mL正丁醇和7.2mL冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用10 mL的水洗涤。有机层继续用10 mL10%Na2CO3洗涤至中性,再用10 mL 的水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥。
③将干燥后的乙酸正丁酯滤入50 mL 烧瓶中,常压蒸馏,收集125~127 ℃的馏分,得11.6 g乙酸正丁酯
请回答有关问题。
(1)冷水应该从冷凝管 ___________(填a或b)管口通入。
(2)步骤①中不断从分水器下部分出生成的水的目的是_________________________
步骤①中判断反应终点的依据是_____________________________________。
(3)产品的精制过程步骤②中,第一次水洗的目的是_____________________________,用饱和Na2CO3溶液洗涤有机层,该步操作的目的是_________________________________。
(4)下列关于分液漏斗的使用叙述正确的是____
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.装液时,分液漏斗中液体的总体积不得超过其容积的2/3
C.萃取振荡操作应如右图所示
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(5)步骤③的常压蒸馏,需收集126℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是_________________________
(6)该实验过程中,生成乙酸正丁酯(式量116)的产率是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
硫在自然界中以游离态和多种化合态形成出现。硫的化合 物大多具有氧化性或还原性。许多金属硫化物难溶于水。
物大多具有氧化性或还原性。许多金属硫化物难溶于水。
完成下列填空:
(1)硫化氢具有还原性,可以和许多氧化剂反 应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式。_________________________________
应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式。_________________________________
(2)石油化工的废气中有H2S。写出从废气中回收单质硫的两种方法(除空气外,不使用其他原料),以化学方程式表示。_____________________、______________________
(3)室温下,0.1mol/L 的硫化钠溶液和0.1mol.L的碳酸钠溶液,碱性更强的是_______,其原因是________。
的硫化钠溶液和0.1mol.L的碳酸钠溶液,碱性更强的是_______,其原因是________。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15
H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
(4)向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象。__________________________
(5)将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有____、______。过滤,微热滤液,然后加入过量的氢氧化钠溶液,可观察到的现象是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com