
【题目】下列离子方程式书写正确的是( )
A.向碳酸钠溶液中加入足量的盐酸:CO32-+2H+=CO2↑+H2O
B.氢氧化钡溶液中加入足量稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++H2O![]() Fe(OH)3↓+H+
Fe(OH)3↓+H+
D.澄清石灰水中加盐酸:Ca(OH)2 +2H+ = Ca2+ + 2H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
具有自主知识产权、中国制造的C919,是一款与波音737MAX同等体量的民用飞机。制造C919需要大量的合金材料,其中包括钢,钢是现代社会的物质基础,钢中除含有铁外还含有碳和少量不可避免的硅、锰、磷、硫等元素。请回答下列有关问题:
(1)基态Mn原子的价电子排布式为___________。
(2)NO3-的立体构型名称为___________,其中心原子的杂化方式为___________。
(3)C、O、Si三种元素第一电离能由大到小的顺序是___________。
(4)写出和CN-互为等电子体的一种离子的电子式___________。
(5)铵盐大多易分解,NH4F和NH4Br两种盐中较易分解的是___________(填化学式);理由是___________。
(6)氧化亚铁晶胞与NaC1的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为apm,该晶体的密度为ρg·cm-3,则a=___________(列出计算式即可,用NA表示阿伏加德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) ![]() zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
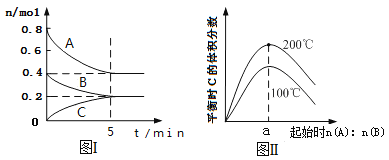
A. 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前υ(正)>υ(逆)
B. 200℃时,反应从开始到刚好达平衡的平均速率υ(B)=0.02 mol·L﹣1·min﹣1
C. 图Ⅱ所知反应xA(g)+yB(g) ![]() zC(g)的△H<0
zC(g)的△H<0
D. 200℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数大于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定碳酸钠纯度(只含有少量氯化钠),学生设计了如下两个实验方案。
[方案1]称取![]() 样品,置于小烧杯中,加适量水完全溶解;向小烧杯中加入足量氢氧化钡溶液,过滤,洗涤、干燥沉淀,称量沉淀的质量为19.700克,计算。
样品,置于小烧杯中,加适量水完全溶解;向小烧杯中加入足量氢氧化钡溶液,过滤,洗涤、干燥沉淀,称量沉淀的质量为19.700克,计算。
(1)写出生成沉淀的反应方程式__________________。
(2)过滤操作需要的玻璃仪器__________________。
(3)计算碳酸钠的质量分数为______________(保留两位小数)。
[方案2]用下图装置,排液法测定![]() 的体积,并根据样品质量和
的体积,并根据样品质量和![]() 的体积计算
的体积计算
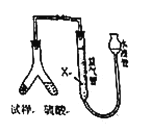
(4)为了减小测定![]() 的体积误差,量气管中加入的液体
的体积误差,量气管中加入的液体![]() 为______(填化学式)。
为______(填化学式)。
(5)通过实验,测得该试样中碳酸钠的质量分数偏高,产生这种现象的原因可能是______。
A.测定气体体积时未冷却至室温
B.气体进入量气管前未用浓硫酸干燥
C.![]() 型管中留有反应生成的气体
型管中留有反应生成的气体
D.反应结束后读数时水准管的水面高于量气管的水面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目信息完成下列方程式。
(1)钛(Ti)因为具有神奇的性能越来越引起人们的关注。地壳中含钛铁矿石之一是金红石(TiO2),目前大规模生产的方法是:
第一步:金红石、炭粉混合,在高温条件下,通入Cl2制得TiCl4和一种可燃气体,该反应的化学方程式为:____________________________________________;
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。写出此反应的化学方程式:____________________________________________。
(2)用100mL 0.1mol/L的NaOH溶液吸收224mLCO2气体(标准状况),恰好完全吸收。再将所得溶液加入100mL 0.1mol/L氢氧化钙溶液中。请写出所得溶液与氢氧化钙溶液反应的离子方程式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料表明:赤热铜能与NO2反应。某小组设计了如下实验装置进行探究,探究固体产物的成分,气体产物是N2还是NO。
已知:酸性KMnO4溶液能氧化NO生成NO3ˉ;
NO和FeSO4溶液反应:NO+FeSO4=[Fe(NO)]SO4(棕色);
Cu2O+2H+=Cu+Cu2++H2O

请回答下列问题:
(1)A中反应的化学方程式为________________________。
(2)检查装置气密性,装好药品,然后实验的正确操作顺序是____________
①关闭K1,打开K2 ②打开分液漏斗活塞
③打开K1,关闭K2 ④点燃C处酒精灯
(3)实验过程中,D装置中的现象是____________,能否根据D装置中的现象确认C中有无NO生成? ______,理由是________________________。
(4)E装置的作用是____________。
(5)当铜粉完全反应后,实验小组对反应后的固体成分提出以下猜想:①只有CuO;②只有Cu2O;有同学认为可通过简单的定性实验即可判断猜想①是否成立,其实验方法是_____________________。
(6)实验中E装置自始至终未显棕色,小组最后通过定量实验得到如下数据。
C装置质量 | F装置气体的体积(已折算为标准状况) | ||
玻管质量 | Cu质量 | 反应后(玻管+生成物) | |
mg | 1.92g | (m+2.24)g | 112mL |
据此写出实验时实际发生反应的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是( )
A.棕红色的NO2加压后颜色先变深后变浅
B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C.黄绿色的氯水光照后颜色变浅
D.合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在自然界中的含量丰富,而且在生活生产中应用广泛。
(1)铁在周期表中的位置为______。
(2)硝普试剂[Fe(NO)CN)5]2-可用于检验S2-,两者反应得紫色溶液,其中两个配体互为等电子体,已知硝普试剂[Fe(NO)(CN)5]2-中Fe为+2价,其基态离子的外围电子排布式为_______。
(3)K4[Fe(CN)6]溶液可用于检验Fe3+,K、C、N的第一电离能由大到小的顺序为______,K4[Fe(CN)6]内界中σ键与π键的个数比为______。
(4)二茂铁是由两个环戊二烯阴离子与Fe2+离子组成的三明治型化合物,即![]() 。环戊二烯分子(
。环戊二烯分子( )中碳原子的杂化方式为_______。
)中碳原子的杂化方式为_______。
(5)工业电解熔融的FeO、Fe2O3冶炼高纯铁。FeO与Fe2O3相比,_____熔点高,其主要原因是_______。
(6)铁单质晶体在不同温度下有两种主要的堆积方式——体心立方(A)与面心立方(B),假定Fe原子半径不变,在两种堆积中,配位数之比NA︰NB为_______晶体密度之比ρA︰ρB为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1molL—1二元弱酸H2A溶液的pH,溶液中的H2A、HA—、A2—的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=c(x)/(c(H2A)+c(HA—)+c(A2—)])。下列叙述正确的是
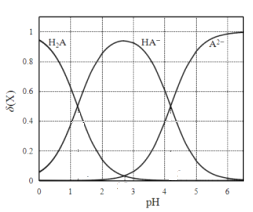
A. Ka2(H2A)的数量级为10-4
B. NaHA溶液中,HA-的水解能力小于HA-的电离能力
C. 在含H2A、HA-和A2-的溶液中,加入少量NaOH固体,δ(HA-)一定增大
D. 将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中δ(HA-)=δ(A2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com