
[��ѧ����ѡ��5���л���ѧ����]
F��G���dz����ĸ߷��Ӳ��ϣ��������ɱ�ϩ�ϳ�F��G������ͼ��
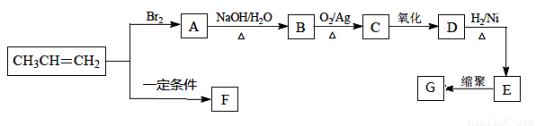
��1��E�Ļ�ѧ������ �������������� ��
��2��G�Ľṹ��ʽ�� ��
��3��A��B�Ļ�ѧ����ʽ�� ���÷�Ӧ������ ��
��4����CH3CH=CH2����F�Ļ�ѧ����ʽ�� ���÷�Ӧ������ ��
��5����һ�������£�������E��ȥ������ˮ�γ�һ����Ԫ��״������û�����Ľṹ��ʽ�� ��
��6��C��ͬ���칹���ж��֣���ֱ�д���������������л���Ľṹ��ʽ��
������NaHCO3��Һ��Ӧ���� ��
���ܷ���ˮ�ⷴӦ���� ��
 ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ������ʮ���ظ������������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪�Ȼ�ѧ����ʽ��
��2H2(g)+O2(g)=2H2O(l) ∆H= -571��6kJ/mol
��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ∆H= -1452kJ/mol
��H+(aq)+OH��(aq)=H2O(l) ∆H= -57��3kJ/mol
�ݴ��ж�����˵����ȷ���ǣ� ��
A��CH3OH��ȼ����Ϊ1452kJ/mol
B��2H2(g)+O2(g)=2H2O(g) ∆H > -571��6kJ/mol
C��2CH3OH(l)+O2(g)=2CO2(g)+4H2(g) ∆H= -880��4kJ/mol
D��CH3COOH(aq)+NaOH(aq)=H2O(l)+CH3COONa(aq) ∆H= -57��3kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������кӶ��������ڶ���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��ҩ�Ŀ�����ҩ��ϳ����л���ѧ�о���Ҫ��չ����ijҩ��V�ĺϳ�·�����£�
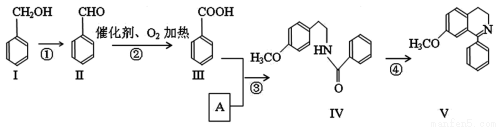
��1�����к��������ŵ����� ��
��2����Ӧ�ڵĻ�ѧ����ʽ
��3����͢���Ũ���������ʱ��Ӧ�Ļ�ѧ����ʽ
��4������˵����ȷ����
A����͢������ڷ����� B�����ܷ���������Ӧ
C��1mol������4molH2�����ӳɷ�Ӧ D����Ӧ������������Ӧ
��5����Ӧ�۵ķ�Ӧ���� ��Ӧ��A�ķ���ʽ
��6�������Ϊͬ���칹�壬����FeCl3������ɫ��Ӧ���䱽���ϵ�һ�ȴ���ֻ��2�֡�
 д���������������Ģ��Ľṹ��ʽ
д���������������Ģ��Ľṹ��ʽ
��7����Ӧ�ܵķ�Ӧ������ ��Ӧ��һ�������£��������Ҳ�ܷ������Ʒ�Ӧ�ܵĻ�����Ӧ�����Ļ�������Ľṹ��ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���Ĵ�ʡ�˱��ظ�����һ����Ӧ�Բ������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
NAΪ�����ӵ�������ֵ������˵���У���ȷ����( )
A��17 g����-14CH3������������Ϊ10NA
B����״���£�0.56L�����к��й��ۼ�����ĿΪ0.2NA
C���ڷ�ӦKClO3+6HCl=KCl+3Cl2��+3H2O�У�ÿ����3molCl2ת�Ƶĵ�����Ϊ5NA
D��0��1mol9038Srԭ���к�������Ϊ3.8NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������к�ƽ�������ڶ���ģ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ȷ���ǣ� ����
A�������еμӰ�ˮ�����ԣ���Һ������Ϊ�Ȼ��
B��ϡ�����ˮϡ�ͣ��������̶�������Һ��pH��С
C������ʯ��ˮ�м�������CaO���ָ������º���Һ��pH����
D����ˮ�еμ���������FeCl3��Һ���γɴ���Ľ��壬����������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����������и���4���ʼ����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��ͭ����Ҫ�ɷ�ΪCuFeS2 ��SΪ-2�ۣ��ǹ�ҵ��ͭ����Ҫԭ�ϣ�����һ����Ȼ��ͭ��SiO2����Ϊ�˲ⶨ�û�ͭ��Ĵ��ȣ����������ʵ�飺
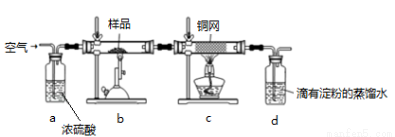
�ֳ�ȡ��ϸ�Ļ�ͭ����Ʒ1.84g���ڿ��������½������գ��������·�Ӧ��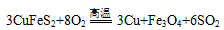
ʵ���ȡd����Һ��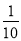 ������ƿ�У���0.0500mol/L������Һ���еζ������ı���Һ20.00mL����ش��������⣺
������ƿ�У���0.0500mol/L������Һ���еζ������ı���Һ20.00mL����ش��������⣺
��1�������������� ��������0.3molSO2����ʱ��ת�Ƶ��� mol��
��2������Ʒ��ϸ���ٷ�Ӧ����Ŀ���� ��װ��c�������� ��
��3���ñ�����Һ�ζ�d����Һ�����ӷ���ʽ�� ���ζ����յ�ʱ�������� ��
��4��������Ӧ����������ͨһ��ʱ��Ŀ�������Ŀ���� ��
��5��ͨ�������֪���û�ͭ��Ĵ���Ϊ ��
��6������ԭװ��d�е���Һ��ΪBa(OH)2��Һ����û�ͭ��ƫ�ߣ�����ʵ���������ȷ�����ܵ�ԭ����Ҫ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����������и���4���ʼ����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ����������������������ء�����˵����ȷ����
A����������������еĵ�
B�����ȵ��ռ���Һϴ�Ӳ;��ϵ�����
C�����ع��͡���ֹʳ�ã�����������ȡ����
D�����������84����Һ���ʹ�ã��ܸ���Ч����߳�����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꺣�ϼλ���ѧ�߶����������ƻ�ѧ�Ծ��������棩 ���ͣ������
��Ȳ��һ����Ҫ���л�����ԭ�ϣ�����ȲΪԭ���ڲ�ͬ�ķ�Ӧ�����¿���ת�������»����
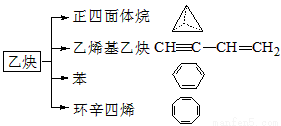
������и��⣺
��1������������ķ���ʽΪ___________�������ȡ��������__________�֡�
��2��������ϩ����Ȳ���ӵ�˵���������__________
a����ʹ����KMnO4��Һ��ɫ
b��1 mol��ϩ����Ȳ����3 mol Br2�����ӳɷ�Ӧ
c����ϩ����Ȳ�����ں������ֹ�����
d������������Ȳ����ϩ����Ȳ��ȫȼ��ʱ�ĺ���������ͬ
��3��д���뻷����ϩ��Ϊͬ���칹�������ڷ������ķ��ӵĽṹ��ʽ�� _____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������������и�����ģ���ۻ�ѧ�Ծ��������棩 ���ͣ������
��Դ�ͻ������������������ע���ȵ㻰�⡣��ش��������⣺
��Ŀǰ����̼���á�����Ϊ��ѧ���о�����Ҫ���⡣��������������һ���Ƚ������ⷽ�����䷴Ӧ����ʽΪCH4(g) +H2O (g) =CO (g) +3H2(g) ��
�Ķ���ͼ������÷�Ӧ�ķ�Ӧ�ȡ�H=____________kJ��mol-1��

���ռ�������CO2�ǻ����������ȵ���⡣
500��ʱ�����ݻ�Ϊ1L���ܱ������г���1 mol CO2��3 mol H2���������·�Ӧ��C02(g) +3H2 (g) =CH3OH (g) +H2O (g) ��H��0�����CO2��CH3OH��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
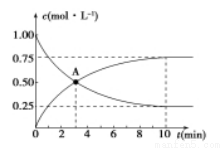
��1�� 0~10 min��v(H2)=_____________�� A�㺬����_____________���÷�Ӧƽ�ⳣ������ʽK=____________��
��2����Ӧ��500��ﵽƽ��ı䷴Ӧ�¶�ΪT�� CH3OH��Ũ����ÿ����0. 030 mol/L������5 min�ִﵽ��ƽ�⡣T______(�>������<����=��)500�棬�ж�������_____________��
��3���¶�ΪTʱ����Ӧ�ﵽƽ�����Ӧ�������ݻ�����һ����ƽ����____________(��������桱)��Ӧ�����ƶ����ж�������____________��
�绯ѧ������SO2��Ŀǰ�о����ȵ㡣
����˫��ˮ����SO2������SO2��Ⱦ�����װ����ͼ��ʾ��
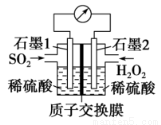
��1��ʯī1Ϊ___________(�������������)�������ĵ缫��ӦʽΪ____________��
��2����11.2 L(��״��)SO2���뷴Ӧ����Ǩ��H+�����ʵ���Ϊ____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com