
新型净水剂—高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O、②Na2FeO4+2KOH=K2FeO4+2NaOH。下列说法不正确的是
A.反应①为氧化还原反应,反应②为复分解反应
B.反应①中氧化产物与还原产物物质的量之比为2:9
C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒
D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、B、C、X是中学化学常见物质,均由短
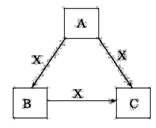 周期元素组成,转化关系如图。
周期元素组成,转化关系如图。
请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素
在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素在元素周期表中的位置为__________,向水中加入X物质,X对水的电离平衡的影响是 (填“促进”、“抑制”或 “无影响”) 。
②A与C的水溶液混合后生成B反应的离子方程式为 。
(2)若A为固态非金属单质,A与X同周期,同时A在X中燃烧,产生白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
①若A为该元素的白色固体单质,则1mol A单质中含共价键数目为 NA ,B的电子式为___________。
②X与水反应的离子方程式为 。
(3)若A、B、C的焰色反应呈黄色,水溶液均为碱性,常温下,X为气态酸性氧化物。
①A中所含有的化学键类型是_____________________。
②C溶液中离子浓度由小到大的顺序是__ _________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据反应①2FeCl3+2KI===2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+ C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于Fe2+和Fe3+的叙述中。错误的是
A.Fe2+的水溶液为浅绿色
B.Fe3+的水溶液为黄色
C.Fe3+具有氧化性,Fe2+具有还原性
D.Fe3+溶液中滴入含SCN-的溶液,立即出现红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,氢氧化锌溶于氨水生成Zn(NH3)22+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表达)。 (2)写出锌和氢氧化钠溶液反应的化学方程式 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式____________________________________________。 试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁一过氧化氢燃料电池具有比能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4 MgSO4+2H2O,结构示意图如图所示。下列关于该电池的叙述正确的是
A.电池内部可以使用MnO2作填料
B.电流工作时,H+向Mg电极移动
C电池工作时,正极的电板反应式为Mg—2e— Mg2+
D.电池工作时,电解质溶液的pH将不断变大
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理 。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是 (填序号)
a.Ba(NO3)2 b.BaCl2 c.Ba(OH)2 d.溶有NH3的BaCl2溶液
③若将足量SO2气体通入0.2 mol·L-1的NaOH溶液,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为 。
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
 (3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作 极(填“正”“负”“阴”或“阳”),其电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作 极(填“正”“负”“阴”或“阳”),其电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.按系统命名法,有机物  可命名为3,7-二甲基-4-乙基辛烷
可命名为3,7-二甲基-4-乙基辛烷
B.1 mol的  最多能与含3 mol NaOH的水溶液完全反应
最多能与含3 mol NaOH的水溶液完全反应
C.纤维素 和壳聚糖
和壳聚糖  均属于多糖
均属于多糖
D.在一定条件下,1.0 mol的 最多能与含3.0 mol NaOH的溶液完全反应
最多能与含3.0 mol NaOH的溶液完全反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com