
(11分)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为________,该元素的符号是________。
(2)Y元素原子的价层电子的电子排布图为________,该元素的名称是________。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________。
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________________________________________________________。
(5)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由
_________________________________________________________________________。
(1)1s22s22p63s23p63d104s24p3 (2分) As(1分)
(2) 或
或 (2分) 氧(1分)
(2分) 氧(1分)
(3)三角锥形(1分)
(4)As2O3 + 6Zn + 6H2SO4==2AsH3↑ + 6ZnSO4 + 3H2O(2分)
(5)稳定性:NH3 > PH3 > AsH3 ,( 2分)因为键长越短,键能越大,化合物稳定(2分)
沸点:NH3>AsH3>PH3,NH3可以形成分子间氢键,沸点最高;AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3的沸点比PH3高
【解析】
试题分析:
X元素原子的4p轨道上有3个未成对电子,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42-8-33=1,则Z为氢元素,氢原子可以形成负一价离子,符合题意.
故X为As元素;Y为氧元素;Z为氢元素.
(1)由上述分析可知,X为As;,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3。
(2) Y元素原子的最外层2p轨道上有2个未成对电子,同样根据电子排布式得到Y为O;再根据X、Y和Z三种元素的原子序数之和等于42可得到Z为H。
(3)X为As元素,XZ3为AsH3,As是sp3杂化的,又只有三个H,即采取不等性杂化,As上有一对孤对电子,分子构型为三角锥形。
(4)X为As元素、Y为氧元素,Z为氢元素.化合物X2Y3为As2O3,XZ3为AsH3,As2O3在稀硫酸溶液中可被金属锌还原为AsH3,产物还有ZnSO4和H2O,反应中Zn元素化合价由0价升高为+2价,As元素化合价由+3价降低为-3价,参加反应的Zn与As2O3的物质的量之比为6×2:2=6:1,反应方程式为As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O。
(5)X为As元素,AsH3与NH3、PH3中,键长N-H<P-H<As-H,键长越短,键能越大,化合物稳定,所以稳定性NH3>PH3>AsH3。故答案为:NH3>PH3>AsH3;键长N-H<P-H<As-H,键长越短,键能越大,化合物稳定.稳定性:NH3 > PH3 > AsH3 ,因为键长越短,键能越大,化合物稳定,沸点:NH3>AsH3>PH3,NH3可以形成分子间氢键,沸点最高;AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3的沸点比PH3高。
考点:原子结构与性质,电子排布
点评:本题考查原子结构与性质,电子排布的规律,难度中等。解题的关键是充分利用题目所给的信息再结合所学的与电子排布有关的知识,按照题目要求逐个作答。其中(4)还涉及到氧化还原反应方程式的配平,是个难点。


科目:高中化学 来源: 题型:
共聚法可改进有机高分子化合物的性质,高分子聚合物P的合成路线如下:
 |
已知:
R—CH2OH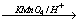 R—COOH(R表示饱和烃基)
R—COOH(R表示饱和烃基)
|
 R—O—R′+H2O (R、R′ 表示烃基)
R—O—R′+H2O (R、R′ 表示烃基) 

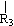
 nCH=CH+nCH=CH
nCH=CH+nCH=CH (R1~R4表示氢或烃基)
(R1~R4表示氢或烃基)

(1)A的结构简式为 。
(2)C的名称为 。
(3)I由F经①~③合成,F可使溴水褪色
a. ①的化学反应方程式是 。
b. ②的反应试剂是 。
c. ③的反应类型是 。
(4)下列说法正确的是 。
a. C可与水以任意比例混溶 b. A与1,3-丁二烯互为同系物
c. I生成M时,1mol I最多消耗3 mol NaOH d. N在一定条件下可发生加聚反应
(5)E与N按照物质的量之比为1︰1发生共聚反应生成P,P的结构简式为 。
(6)E有多种同分异构体,写出其中一种符合下列条件的异构体的结构简式 。
a. 分子中只含一种环状结构
b. 苯环上有两个取代基
c. 1mol该有机物与溴水反应时能消耗4 mol Br2
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省淄博市高二12月月考化学试卷(解析版) 题型:选择题
下列措施能加快Fe与0.1mol/L的稀H2SO4反应产生H2的反应速率的是
A.向溶液中再滴加1mol/L的HNO3 B.将稀硫酸改为98%的浓硫酸
C.滴加少量的CuSO4 溶液 D.降低温度
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省东营市高一上学期第三次模块考试化学试卷(解析版) 题型:选择题
下列关于浓硝酸和浓硫酸的叙述,不正确的是
A. 常温下都能用铝制容器贮存
B. 浓硝酸必须保存在棕色试剂瓶中,浓硫酸则不需要
C. 常温下都能与铜较快反应
D. 露置在空气中,容器内酸液的浓度都降低
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省东营市高一上学期第三次模块考试化学试卷(解析版) 题型:选择题
为了除去CO2中少量的HCI气体,最好将混合气体通过
A、浓硫酸 B、NaHCO3饱和溶液 C、NaOH溶液 D、Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省邢台市高二12月月考化学试卷(解析版) 题型:选择题
磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的。右图是Mn和Bi形成的某种晶体的结构示意图(白球均在六棱柱内),则该晶体物质的化学式可表示为

A.Mn2Bi B.MnBi C.MnBi3 D.Mn4Bi3
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省邢台市高二12月月考化学试卷(解析版) 题型:选择题
下列各组物质中,按熔点由低到高的顺序排列正确的是
①O2、I2、Hg ②CO、KCl、SiO2 ③Na、K、Rb ④Na、Mg、Al
A.①③ B.①④ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市闵行区高二第一学期期末考试化学试卷(解析版) 题型:选择题
下列离子方程式中,正确的是
A.Fe片投入浓硫酸中:Fe+2H+ → Fe2++H2↑
B.硫酸铝溶液滴入过量烧碱溶液中:Al3++4OH-→ AlO2-+ 2H2O
C.FeS放入稀盐酸溶液中:S2-+2H+ →H2S↑
D.在AlCl3溶液中加入过量氨水:Al3++4NH3·H2O → AlO2-+4NH4++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com