
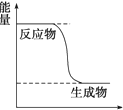
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.分析 (1)A.由图可知,反应物总能量小于生成物总能量,反应为放热反应;
B.速率之比等于其化学计量数之比;
C.化学变化本质是旧键断裂,原子总组合生成新物质,形成新的化学键;
D.1mol H-O键断裂的同时2mol C=O键断裂,等于化学计量数之比,反应到达平衡;
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol•L-1,则:
CH3OH(g)+$\frac{1}{2}$O2(g)?CO2(g)+2H2(g)
起始浓度(mol/L):2.5 1 0 0
变化浓度(mol/L):1.6 0.8 0.8 3.2
平衡浓度(mol/L):0.9 0.2 0.8 3.2
根据v=$\frac{△c}{△t}$计算v(H2),CH3OH的转化率=$\frac{甲醇浓度变化量}{甲醇起始浓度}$×100%;
(3)A.原电池负极发生氧化反应,正极发生还原反应;
B.电池放电时负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子,
C.反应会消耗KOH,溶液碱性减弱;
D.碱性条件下,CH3OH为氧化为CO32-,结合碳元素化合价变化计算转移电子;
(4)负极发生氧化反应,甲醇在负极失去电子,酸性条件下生成CO2,根据电荷守恒可知,有氢离子生成.
解答 解:(1)A.由图可知,反应物总能量小于生成物总能量,反应为放热反应,故A错误;
B.速率之比等于其化学计量数之比,H2的生成速率与CH3OH的消耗速率之比为2:1,故B错误;
C.化学变化本质是旧键断裂,原子总组合生成新物质,形成新的化学键,化学变化不仅有新物质生成,同时也一定有能量变化,故C正确;
D.1mol H-O键断裂的同时2mol C=O键断裂,分别表示正、逆反应速率,等于化学计量数之比,反应到达平衡,故D正确,
故答案为:CD;
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol•L-1,则:
CH3OH(g)+$\frac{1}{2}$O2(g)?CO2(g)+2H2(g)
起始浓度(mol/L):2.5 1 0 0
变化浓度(mol/L):1.6 0.8 1.6 3.2
平衡浓度(mol/L):0.9 0.2 1.6 3.2
故v(H2)=$\frac{3.2mol/L}{4min}$=0.8mol/(L.min);
CH3OH的转化率=$\frac{1.6mol/L}{2.5mol/L}$×100%=64%,
故答案为:0.8mol/(L.min);64%;
(3)A.原电池负极发生氧化反应,正极发生还原反应,再正极通入氧气,故A错误;
B.电池放电时负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子,负极电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O,故B错误;
C.反应会消耗KOH,溶液碱性减弱,故C正确;
D.消耗6.4gCH3OH,其物质的量为$\frac{6.4g}{32g/mol}$=0.2mol,碱性条件下,CH3OH为氧化为CO32-,转移电子为0.2mol×6=1.2mol,故D正确,
故选:CD;
(4)负极发生氧化反应,甲醇在负极失去电子,酸性条件下生成CO2,根据电荷守恒可知,有氢离子生成,负极电极反应式为:CH3OH+H2O-6e-═CO2↑+6H+,
故答案为:CH3OH+H2O-6e-═CO2↑+6H+.
点评 本题考查较为综合,涉及化学平衡计算、原电池原理、化学反应中能量变化等,为高考常见题型和高频考点,侧重常考知识点的考查,需要学生熟练掌握基础知识并灵活运用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、OH-、HCO3- | B. | Fe2+、H+、CO32-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和乙烯都可以使溴水褪色 | |
| B. | 乙醇和乙酸都存在碳氧双键 | |
| C. | 高锰酸钾酸性溶液不可以氧化苯和甲烷 | |
| D. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .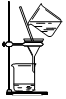 装置可用于除去乙醇中的溴苯 | |
| B. | .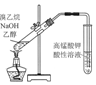 用图所示装置检验溴乙烷与NaOH醇溶液共热产生的C2H4 | |
| C. | .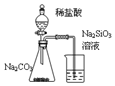 装置可证明非金属性Cl>C>Si | |
| D. | 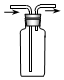 装置可用于收集O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 | |
| B. | 分别用盛满HCl气体和盛满NO2气体的烧瓶做喷泉实验,喷泉结束后,所得溶液的物质的量浓度相同 | |
| C. | 向50 mL 18 mol•L-1 的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol | |
| D. | 常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
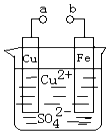
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Fe-3e-═Fe3+ | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 | |
| D. | a和b用导线连接后,铁片上发生还原反应,溶液中铜离子向铜电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
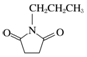 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com