
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 某校学习小组进行下述实验探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了如图的实验装置(夹持仪器已略去).
某校学习小组进行下述实验探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了如图的实验装置(夹持仪器已略去).查看答案和解析>>
科目:高中化学 来源:山西省太原五中2011-2012学年高二上学期期中考试化学理科试题(人教版) 题型:022
现有下列物质:
①H2S、
②NH3、
③H2SO4、
④NaHCO3、
⑤CH3COOH、
⑥KNO3溶液、
⑦盐酸、
⑧酒精、
⑨二元酸H2A等.
请回答下列问题(请填入序号).
(1)其中一定属于弱电解质的是________.不能确定的是________,请设计一个实验以证明它是强电解质还是弱电解质.你的实验和结论是________;
(2)H2S在水中的电离方程式为________;NaHCO3在水中的电离方程式为________;已知H2A的电离方程式为:H2A![]() H++HA-;HA-
H++HA-;HA-![]() H++A2-.试判断H2A是________电解质(填“强”或“弱”).
H++A2-.试判断H2A是________电解质(填“强”或“弱”).
(3)2 mol/L的盐酸和2 mol/L的醋酸各100 ml,分别与过量的Zn反应,生成H2的体积,V(盐酸)________V(醋酸)(填>、=或<);氢离子浓度相等的盐酸和醋酸各100 ml,分别与过量的Zn反应,生成H2的体积V(盐酸)________V(醋酸)(填>、=或<);理由是________;
(4)已知CH3COO-+H+![]() CH3COOH;现要使平衡向右移动且氢离子浓度增大,应采取的措施是________
CH3COOH;现要使平衡向右移动且氢离子浓度增大,应采取的措施是________
A.加NaOH
B.加盐酸
C.加水
D.升高温度
已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂.则CH3COOH在溶剂A中的电离方程式为________;CH3COOH和Na2CO3在溶剂A中生成CO2反应的离子方程式是________.
查看答案和解析>>
科目:高中化学 来源:2011-2012年山西省高二上学期期中考试化学(理)试卷 题型:填空题
(18分)、现有下列物质:①H2S、②NH3、③H2SO4、④NaHCO3、
⑤CH3COOH、⑥KNO3溶液、⑦盐酸、⑧酒精、⑨二元酸H2A等。请回答下列问题(请填入序号)。
(1)其中一定属于弱电解质的是 。不能确定的是 ,请设计一个实验以证明它是强电解质还是弱电解质。你的实验和结论是
;
(2)H2S在水中的电离方程式为 __________;
NaHCO3在水中的电离方程式为 ;
 已知H2A的电离方程式为:H2A == H++HA-; HA-
H++A2-。试判断H2A是 电解质(填“强”或“弱”)。
已知H2A的电离方程式为:H2A == H++HA-; HA-
H++A2-。试判断H2A是 电解质(填“强”或“弱”)。
(3)2mol/L的盐酸和2mol/L的醋酸各100ml,分别与过量的Zn反应,生成H2的体积,V(盐酸) V(醋酸)(填>、=或<);氢离子浓度相等的盐酸和醋酸各100ml,分别与过量的Zn反应,生成H2的体积V(盐酸) V(醋酸) (填>、=或<);理由是
;
 (4)已知CH3COO-+H+
CH3COOH;现要使平衡向右移动且氢离子浓度增大,应采取的措施是( )
(4)已知CH3COO-+H+
CH3COOH;现要使平衡向右移动且氢离子浓度增大,应采取的措施是( )
A.加NaOH B.加盐酸 C.加水 D.升高温度
已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂。则CH3COOH在溶剂A中的电离方程式为 ;CH3COOH和Na2CO3在溶剂A中生成CO2反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
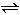 CH3COOH+OH-而使溶液呈碱性。
CH3COOH+OH-而使溶液呈碱性。查看答案和解析>>
科目:高中化学 来源:2011-2012年山西省太原五中高二上学期期中考试化学(理)试卷 题型:填空题
(18分)、现有下列物质:①H2S、②NH3、③H2SO4、④NaHCO3、
⑤CH3COOH、⑥KNO3溶液、⑦盐酸、⑧酒精、⑨二元酸H2A等。请回答下列问题(请填入序号)。
(1)其中一定属于弱电解质的是 。不能确定的是 ,请设计一个实验以证明它是强电解质还是弱电解质。你的实验和结论是
;
(2)H2S在水中的电离方程式为 __________;
NaHCO3在水中的电离方程式为 ; 已知H2A的电离方程式为:H2A ="=" H++HA-; HA- H++A2-。试判断H2A是 电解质(填“强”或“弱”)。
已知H2A的电离方程式为:H2A ="=" H++HA-; HA- H++A2-。试判断H2A是 电解质(填“强”或“弱”)。
(3)2mol/L的盐酸和2mol/L的醋酸各100ml,分别与过量的Zn反应,生成H2的体积,V(盐酸) V(醋酸)(填>、=或<);氢离子浓度相等的盐酸和醋酸各100ml,分别与过量的Zn反应,生成H2的体积V(盐酸) V(醋酸) (填>、=或<);理由是
; (4)已知CH3COO-+H+ CH3COOH;现要使平衡向右移动且氢离子浓度增大,应采取的措施是( )
(4)已知CH3COO-+H+ CH3COOH;现要使平衡向右移动且氢离子浓度增大,应采取的措施是( )
| A.加NaOH | B.加盐酸 | C.加水 | D.升高温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com