
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.根据判断出的元素回答下列问题:
(1)f在元素周期表的位置是 .
(2)比较y、g、h最高价氧化物对应水化物的酸性强弱是:>> . (用化学式表示)
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,其电子式为;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为 . (填序号)A.MnO2B.FeCl3C.Na2SO3D.KMnO4
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:  ①X溶液与Y溶液反应的离子方程式为
①X溶液与Y溶液反应的离子方程式为
②常温下,为使0.1mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至
(5)上述元素可组成盐R:zx4f(gd4)2 , 向盛有10mL 1molL﹣1 R溶液的烧杯中滴加1molL﹣1NaOH溶液,沉淀的物质的量随NaOH溶液体积变化如图所示:
①写出m点反应的离子方程式 .
②若R溶液中改加20mL 1.2molL﹣1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为mol.
【答案】
(1)第三周期ⅢA族
(2)HClO4;H2SO4;H2CO3
(3)![]() ;AB
;AB
(4)Al3++3NH3?H2O=Al(OH)3↓+3NH4+;溶液呈中性
(5)NH4++OH﹣=NH3?H2O;0.022
【解析】解:从图中的化合价和原子半径的大小,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族,所以答案是:第三周期ⅢA族;(2)非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4>H2CO3 ,
所以答案是:HClO4>H2SO4>H2CO3;(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,则A为Na2O2 , 其电子式为 ![]() ,B是常见的液态化合物,其稀溶液易被催化分解,则B为H2O2 , 能使双氧水解的催化剂为MnO2、FeCl3 , 故选AB,
,B是常见的液态化合物,其稀溶液易被催化分解,则B为H2O2 , 能使双氧水解的催化剂为MnO2、FeCl3 , 故选AB,
所以答案是: ![]() ;AB;(4)①由
;AB;(4)①由 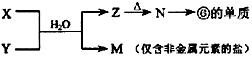 反应转化可知,f为Al元素,则N为Al2O3 , Z为Al(OH)3 , M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3H2O=Al(OH)3↓+3NH4+ ,
反应转化可知,f为Al元素,则N为Al2O3 , Z为Al(OH)3 , M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3H2O=Al(OH)3↓+3NH4+ ,
所以答案是:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
②M溶液中铵根离子水解呈酸性,要使0.1mol/L M 溶液中由M电离的阴、阳离子浓度相等,根据溶液的电中性可知c(H+)=c(OH﹣),所以应向溶液中加入一定量的Y溶液至溶液呈中性,
所以答案是:溶液呈中性;(5)①m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH﹣反应生成NH3H2O,离子方程式为:NH4++OH﹣=NH3H2O,
所以答案是:NH4++OH﹣=NH3H2O;
②10mL 1molL﹣1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42﹣的物质的量为0.02mol,20mL 1.2 molL﹣1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH﹣为0.048mol,
由SO42﹣+Ba2+=BaSO4↓,可知SO42﹣不足,故可以得到0.02mol BaSO4 ,
Al3++3OH﹣=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH﹣为0.048mol﹣0.03mol=0.018mol,
NH4++OH﹣=NH3H2O
0.01mol 0.01mol
反应剩余OH﹣为0.018mol﹣0.01mol=0.008mol,
Al(OH)3+OH﹣=AlO2﹣+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol﹣0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
所以答案是:0.022.


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:Al3++4NH3·H2O![]() AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B. 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-![]() CaCO3↓+H2O
CaCO3↓+H2O
C. 碳酸钙溶于醋酸:CaCO3+2H+![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
D. 氯化亚铁溶液中通入氯气:2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像与对应的叙述相符的是
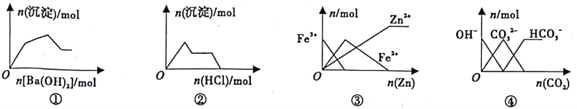
A. 图①表示向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
B. 图②表示向NaAlO2溶波中逐滴加入盐酸
C. 图③表示向FeCl3溶液中加入锌粉
D. 图④表示向NaOH溶液通入CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列对溶液中溶质组成成分判断正确的是( )
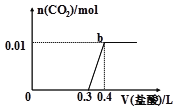
A. 原溶液中溶质为Na2CO3和NaHCO3
B. 原溶液中溶质为NaOH和Na2CO3
C. 原溶液中溶质为Na2CO3
D. 原溶液中溶质为NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于石油的说法不正确的是( )
A.石油主要含C、H两种元素
B.石油通过催化重整可得到环状烃
C.石油裂化是物理变化
D.石油分馏得到的汽油是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去.已知室温下Ksp(FeS)=6.3×10﹣18mol2L﹣2 , Ksp(CuS)=1.3×10﹣36mol2L﹣2 . ①请用离子方程式说明上述除杂的原理 .
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是(填序号)
A.Ba(NO3)2B.BaCl2
C.Ba(OH)2D.溶有NH3的BaCl2溶液
③已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 .
(2)电解法处理酸性含铬废水(主要含有Cr2O72﹣)时,在废水中加入适量NaCl,以铁板作阴、阳极,处理过程中存在如下反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是(填序号)
A.阳极反应为Fe﹣2e﹣═Fe2+
B.电解过程中溶液pH减小
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有2mol Cr2O72﹣被还原
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池.图是该燃料电池示意图,产生的X气体可直接排放到大气中,a电极作极(填“正”“负”“阴”或“阳”),其电极反应式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 利用化石燃料燃烧放出的热量使水分解产生氢气,是氢能开发的研究方向
B. 光合作用是将光能转化为化学能的有效途径
C. 石油、煤、天然气属于二次能源
D. 绿色化学最显著的特征是在生产化工产品过程中必须利用绿色植物为原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com