
| A. | (SCN)2+2Br-→Br2+2SCN- | |
| B. | (SCN)2+H2S→2H++2SCN-+S↓ | |
| C. | 4H++2SCN-+MnO2 $\stackrel{△}{→}$Mn2++(SCN)2↑+2H2O | |
| D. | (SCN)2+2I-→2SCN-+I2 |
分析 依据拟卤素离子与卤离子还原性强弱顺序为Cl-<Br-<SCN-<I-,又知氧化性I2>S,可知:氧化性强弱顺序为:Cl2>Br2>(SCN)2>I2>S,结合氧化还原反应中强弱规律判断反应能否发生.
解答 解:依据拟卤素离子与卤离子还原性强弱顺序为Cl-<Br-<SCN-<I-,又知氧化性I2>S,可知:氧化性强弱顺序为:Cl2>Br2>(SCN)2>I2>S,
A.若(SCN)2+2Br-→Br2+2SCN-能够发生则氧化性,Br2<(SCN)2,与题干不符合,故A错误;
B.氧化性:(SCN)2>S,依据氧化还原反应强弱规律可知:SCN)2+H2S→2H++2SCN-+S↓能够发生,故B正确;
C.氧化性:Cl2>(SCN)2,二氧化锰能氧化氯离子生成氯气,则4H++2SCN-+MnO2 $\stackrel{△}{→}$Mn2++(SCN)2↑+2H2O,能够发生,故C正确;
D.氧化性:(SCN)2>I2,依据氧化还原反应强弱规律可知(SCN)2+2I-→2SCN-+I2,能够发生,故D正确;
故选:A.
点评 本题考查氧化还原反应,难度不大,明确离子的还原性顺序及其能够发生的反应是解本题关键,注意对知识的迁移应用,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 不同元素的原子发生跃迁时,会释放不同的光 | |
| B. | 第一电离能与电负性的数值都是以气态中性基态原子为研究对象测得到 | |
| C. | 分子中的原子有固定的空间位置,组成完全相同的分子,由于原子位置的不同会表现出不同的性质 | |
| D. | 两个相同的原子的任意未成对电子的电子云在两个原子核间重叠,形成非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2 | B. | 3 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
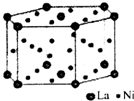 自然界存在的元素中,丰度最大的是非金属.80%以上的非金属在现代技术包括能源、功能材料等领域占有极为重要的地位.
自然界存在的元素中,丰度最大的是非金属.80%以上的非金属在现代技术包括能源、功能材料等领域占有极为重要的地位. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-2-丁烯 | B. | 3-甲基-1-丁烯 | C. | 3-甲基-2-丁烯 | D. | 2-甲基-1-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图中A、B、C、D是同周期或同主族的相邻元素:
图中A、B、C、D是同周期或同主族的相邻元素:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com