
分析 (1)反应中产物气体数和小于反应物气体系数和,据此判断反应熵变符号;根据盖斯定律确定所求反应和已知反应之间的关系,计算反应的焓变即可;
(2)①反应达到平衡状态,各组分的浓度不随着时间的变化而变化,正逆反应速率相等,根据化学平衡状态的特征结合变量不变的状态是平衡状态来回答;
②反应是放热的,所以温度升高,平衡逆向进行,反应物的转化率降低,据此回答;
③根据三行式结合化学平衡常数表达式来进行计算即可.
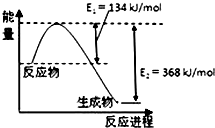
解答 解:(1)反应中产物气体数和小于反应物气体系数和,反应熵变小于零,反应①:CO2(g)+H2(g)=CO(g)+H2O(g)△H1=+41.19kJ•mol-1,反应②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H3=-49.58kJ•mol-1,反应CO(g)+2H2(g)=CH3OH(g)可以看成是②-①得到,所以反应焓变=-49.58kJ•mol-1-41.19kJ•mol-1=-90.77 kJ•mol-1,故答案为:<;-90.77 kJ•mol-1;
(2)①A.断裂3molH-H键,同时有2molH-O键形成,只能说明反应正向进行,不能说明正逆反应速率相等,此时的状态不一定平衡,故A正确;
B.CH3OH的浓度不再改变的状态是平衡状态的特征,故B错误;
C.容器中气体的平均摩尔质量等于质量和物质的量的比值,质量守恒,但是物质的量始终变化,所以当气体的平均摩尔质量不变的状态是平衡状态,故C错误;
D.容器中的反应是在恒压下进行的,当容器中气体的压强不变时,不一定是平衡状态,故D正确.
故选AD.
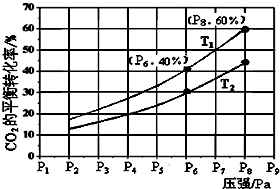
②反应Ⅲ为放热反应,温度降低,反应正向移动,二氧化碳的转化率升高,所以T1<T2,故答案为:<;反应Ⅲ为放热反应,温度降低,反应正向移动,二氧化碳的转化率升高,所以T1<T2;
③CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
初始量:1mol 3mol 0 0
变化量:0.4mol 1.2mol 0.4mol 0.4mol
平衡量:0.6mol 1.8mol 0.4mol 0.4mol
K=$\frac{\frac{0.4}{1.8}×\frac{0.4}{1.8}}{\frac{0.6}{1.8}×\frac{1.8}{1.8}}$=0.148,(3)CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
初始量:1mol 3mol 0 0
变化量:0.4mol 1.2mol 0.4mol 0.4mol
平衡量:0.6mol 1.8mol 0.4mol 0.4mol
K=$\frac{\frac{0.4}{1.8}×\frac{0.4}{1.8}}{\frac{0.6}{1.8}×(\frac{1.8}{1.8})^{3}}$=0.148,若温度不变,K不变,压强恒定在P8的条件下重新达到平衡时,
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
初始量:1mol 3mol 0 0
变化量:0.6mol 1.8mol 0.6mol 0.6mol
平衡量:0.4mol 1.2mol 0.6mol 0.6mol
K=$\frac{\frac{0.6}{V}×\frac{0.6}{V}}{\frac{0.4}{V}×(\frac{1.2}{V})^{3}}$=$\frac{4}{27}$,解得V=$\frac{8}{15}$=0.533.
故答案为:0.148;0.533.
点评 本题涉及化学平衡的判断、计算以及热化学方程式的书写知识,注意盖斯定律的应用是关键,难度不大.


科目:高中化学 来源: 题型:解答题
 氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉既可做漂白棉麻纸张的溧白剂,又可做游泳池及环境的消毒剂 | |
| B. | 氮肥包括铵态氮肥、硝态氮肥和尿素 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 硅胶可用作食品干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH小于7的雨水被称为酸雨 | |
| B. | 推广使用燃煤脱硫技术,主要是为了防治SO2污染 | |
| C. | 为防止富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 明矾溶于水可产生具有吸附性的胶体粒子,常用于饮用水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
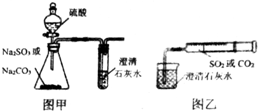 某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.
某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
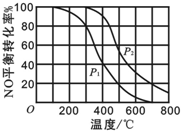 (1)汽车尾气是造成空气污染产生雾霾的原因之一.其中涉及的反应2NO(g)+O2?2NO2(g)在其他条件不变达平衡时.分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线如图所示.
(1)汽车尾气是造成空气污染产生雾霾的原因之一.其中涉及的反应2NO(g)+O2?2NO2(g)在其他条件不变达平衡时.分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
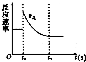 如图表示可逆反应A(g)+3B(g)?2C(g)△H<0达平衡后,t1时改变某一反应条件,反应速率随时间变化的情况,根据曲线判断下列说法中正确的是( )
如图表示可逆反应A(g)+3B(g)?2C(g)△H<0达平衡后,t1时改变某一反应条件,反应速率随时间变化的情况,根据曲线判断下列说法中正确的是( )| A. | t1时降低了温度,平衡向正反应方向移动 | |
| B. | t1时增大了压强,平衡向正反应方向移动 | |
| C. | t1时可能使用了催化剂 | |
| D. | t1时增大了A的浓度,同时减小了C的浓度,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制造光导纤维 | |
| B. | SiO2是酸性氧化物,不溶于任何酸 | |
| C. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| D. | 石灰石是生产玻璃和水泥的主要原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com