
| 蔗糖 | 磷酸 | 碘 | 萘 | |
| (1)水 | ||||
| (2)四氯化碳 |
| 蔗糖 | 磷酸 | 碘 | 萘 | |
| (1)水 | 易溶 | 易溶 | 不易溶 | 不易溶 |
| (2)四氯化碳 | 不易溶 | 不易溶 | 易溶 | 易溶 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、制备Fe(OH)3胶体的反应:Fe3++3H2O
| ||||
| B、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | ||||
| C、将氯气溶于水:C12+H2O═2H++Cl-+ClO- | ||||
| D、用稀氢氧化钠溶液吸收二氧化氮尾气:2OH-+2NO2═NO3-+NO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
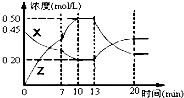 向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g)△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )
向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g)△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )| A、用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L?min) |
| B、化学方程式中a:b=1:3 |
| C、推测在第7min时曲线变化的原因可能是增加X的浓度 |
| D、推测该反应处于化学平衡状态的时间是10min--13min及第20min后 |
查看答案和解析>>
科目:高中化学 来源: 题型:
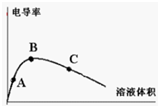 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.| 醋酸浓度(mol?L-1) | 0.0010 | 0.100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
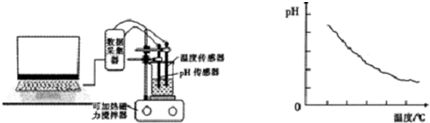
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水溶液中通人足量二氧化硫气体:OH-+SO2=HSO3-- | ||||
B、用惰性电极电解饱和氯化钠溶液:2Cl-+2H +
| ||||
| C、用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-=3Ag++NO↑+2H2O | ||||
| D、次氯酸钙溶液中通人少量二氧化硫:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com