
答案 A
解析 本题考查氧化还原反应和阿伏加德罗定律及元素化合物知识,意在考查学生利用有关定律进行数据处理的能力。氮氧化合物与铜粉反应生成CuO和N2,结合题中气体体积和阿伏加德罗定律可推知该氮的氧化物分子中只含有一个氮原子,结合选项知A正确。
★ ★★
科目:高中化学 来源: 题型:
答案 原子半径、原子间形成的共用电子对数目。形成相同数目的共用电子对,原子半径越小,共价键的键长越短;原子半径相同,形成共用电子对数目越多,键长越短。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/ (kJ·mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是______________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是______________________。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
O3能吸附有害紫外线,保护人类赖以生存的空间。O3分子的结构如下图所示:呈V形,键角116.5°。三个O原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键:中间O原子提供2个电子,旁边两个O原子分别各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:
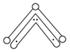
(1)题中非极性共价键是________键,特殊的化学键是________键(填“σ”或“π”)。
(2)1919年,Langmuir提出等电子体的概念:由短周期元素组成的粒子,只要其原子数相等,各原子外层电子数之和相等,也可互称为等电子体。等电子体的结构相似,物理性质相近,根据等电子原理:下列物质的分子与O3分子的结构最相似的是________(填字母)。
A.H2O B.CO2
C.SO2 D.BeCl2
(3)原子中没有跟其他原子共用的电子对叫孤电子对,那么O3分子有________对孤电子对。
(4)下列有关说法中正确的是________(填字母)。
A.臭氧和氧气互为同素异形体,它们在水中的溶解度相近
B.臭氧和氧气的相互转化能保持大气中臭氧的含量基本稳定
C.臭氧转化为氧气和氧气转化为臭氧均需要吸收能量
D.向大气中排放氮的氧化物和氟氯代烃均能加快臭氧的分解
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
固态NH4Cl受热变成气体,气体遇冷又变为固态NH4Cl;固态碘受热变成蒸气,蒸气遇冷又变成固态碘,这两种现象的本质是否相同?请说明判断的理由。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )


A.①是氨气发生装置 B.③是氨气发生装置
C.②是氨气吸收装置 D.④是氨气收集、检验装置
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
用“元素符号”填空
(1)最高正价与最低负价代数和为0的短周期元素__________________。
(2)最高正价是最低负价绝对值3倍的短周期元素是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知错误的是( )
A.x的原子半径大于y的原子半径 B.x的电负性大于y的电负性
C.x的氧化性大于y的氧化性 D.x的第一电离能大于y的第一电离能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com