
“铝热反应”的化学方程式为:2Al+Fe2O3 Al2O3+2Fe.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Al2O3+2Fe.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | ﹣﹣ |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金.这种推测有一定的道理,理由是: .
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是 ,当观察到 现象时,说明熔融物中含有金属铝,反应的离子方程式为 .
(3)实验室溶解该熔融物,最好选用下列试剂中的 (填序号).
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液.
考点:
铝金属及其化合物的性质实验;探究铝与酸、碱溶液的反应;性质实验方案的设计.
专题:
实验题.
分析:
(1)当金属铁是液态时,由于金属铝的熔点比铁低,所以金属铝也是液态;
(2)金属铝能和氢氧化钠反应放出氢气而金属铁和氢氧化钠不反应;
(3)既能和金属铁反应又能和金属铝反应的物质是稀硫酸,并且获得的产物无污染.
解答:
解:(1)根据表中的数据可以看出,金属铝的熔点比铁低,当金属铁是液态时,金属铝也是液态,所以铝热反应得到的是金属铁和金属铝的混合物,故答案为:金属铝的熔点比铁低;
(2)金属铝能和氢氧化钠反应放出氢气而金属铁和氢氧化钠不反应,反应实质是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,可以用氢氧化钠溶液证明上述所得的块状熔融物中含有金属铝,
故答案为:氢氧化钠溶液;有气泡产生;2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
(3)既能和金属铁反应又能和金属铝反应的物质是稀硫酸,并且获得的产物无污染,浓硫酸在常温下可以和金属铝钝化,稀硝酸可以和金属反应产生有毒的一氧化氮气体,氢氧化钠只和金属铝反应而和金属铁不反应.故选B.
点评:
本题考查学生金属铝的化学性质,可以根据所学知识进行回答,难度不大.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
某化合物64g在氧气中完全燃烧,只生成88g CO2和72g H2O.下列说法正确的是( )
|
| A. | 该化合物仅含碳、氢两种元素 |
|
| B. | 该化合物中碳、氢原子个数比为1:4 |
|
| C. | 无法确定该化合物是否含有氧元素 |
|
| D. | 该化合物中一定含有氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于硝酸的说法正确的是( )
|
| A. | 硝酸与金属反应时,主要是+5价的氮得电子 |
|
| B. | 浓HNO3与浓HCl按3:1的体积比所得的混合物叫王水 |
|
| C. | 硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 |
|
| D. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
50mL 0.50mol•L﹣1的盐酸与50mL 0.55mol•L﹣1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,完成下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 .请指出装置中的另外错误是 .
(2)烧杯间填满碎纸条的作用是 .
(3)大烧杯上如不盖硬纸板,求得的中和热 (填“偏大”“偏小”“无影响”).
(4)实验中改用60mL 0.50 mol•L﹣1的盐酸跟60mL 0.55 mol•L﹣1NaOH溶液进行上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”).
(5)用相同浓度体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50mL 0.50mol•L﹣1NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”“偏小”“无影响”).

查看答案和解析>>
科目:高中化学 来源: 题型:
如图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )
| a极板 | b极板 | X电极 | 电解质溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
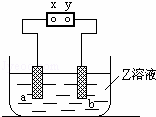
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl﹣、Br﹣(溴离子)、SO42﹣、Na+、Mg2+、Ca2+等,都是重要资源.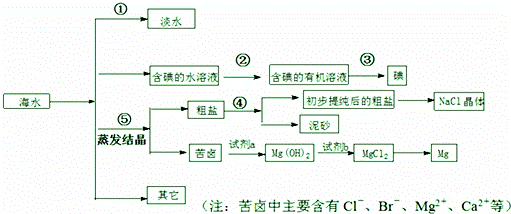
(1)写出步骤①、②、④分离提纯的方法:
① ② ④
(2)步骤②分离提纯过程中需要选用主要玻璃仪器的名称 .
(3)欲除去初步提纯后的粗盐中的MgCl2、CaCl2和Na2SO4,应向该粗食盐水中依次加入NaOH溶液、 溶液、 溶液,然后过滤;为尽可能除去杂质,每次加入的试剂应 量.向所得溶液中滴加 至无气泡产生,再经蒸发结晶得到食盐晶体.
(4)检验淡水中是否含有Cl﹣ 的操作现象及结论 .
(5)写出加入试剂a后,发生反应的离子方程式 .
(6)工业上用电解饱和食盐水的方法生产氯气、氢气和烧碱,请写出利用氯气和消石灰制取漂白粉的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
1体积SO2和3体积空气混合后,在450℃以上通过V2O5催化剂,发生如下反应:2SO2(g)+O2(g)⇌2SO3(g)若同温同压下测得反应前后混合气体的密度比为0.9:1,则反应掉的SO2是原有SO2的百分之几?
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室里做钠跟水反应的实验时,用到的仪器和药品是( )
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤研钵 ⑥烧杯 ⑦坩埚 ⑧石棉网 ⑨玻璃片 ⑩药匙.
A. ①②③④ B. ②③④⑥⑨ C. ③④⑧⑨⑩ D. ②⑤⑦⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)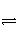
 2C(g)达到平衡状态标志的是( )
2C(g)达到平衡状态标志的是( )
①C生成的速率与C分解的速率相等
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化
④A、B、C的压强不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成3amolB
⑧A、B、C的分子数之比为1∶3∶2
A.②⑧B.①⑥C.②④D.③⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com