
下列有关化学键的说法中错误的是( )
A.氯化钠熔化或氯化氢溶于水时都要破坏化学键
B.离子化合物中可能含有共价键,共价化合物中一定不含有离子键
C.氯化铵受热变成气体,冷却后又成晶体,此过程中化学键没有发生变化
D.碘晶体升华和冰融化时都未涉及化学键的变化
科目:高中化学 来源: 题型:
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
请回答下列问题:
(1)该反应平衡常数表达式为K=________;ΔH________0(填“>”“<”或“=”)。
(2)830 ℃时,向一个5 L的密闭 容器中充入0.20 mol的A和0.80 mol的B,若测得反应初始至6 s内A的平衡反应速率v(A)=0.003 mol·L-1·s-1,则6 s时c(A)=________mol·L-1;C的物质的量为________mol。
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为________;如果这时向该密闭容器中再充入1mol氩气,则平衡时A的转化率________(填“增大”“减小”或“不变”)。
(4)判断该反应是否达到平衡的依据为________(填正确选项的字母)。
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(A)不随时间改变
D.单位时间里生成C和D的物质的量相等
(5)1 200 ℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
“绿色化学”的核心理念是:原子经济性原则。即力求反应物分子中的所有原子全都转化到目标产物中,理想状态的原子利用率为100%。在合成1,2—二溴乙烷时,原子利用率最高的途径是
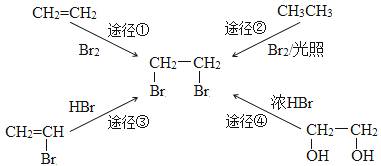
A.途径① B.途径② C.途径③ D.途径④
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期律产生的根本原因就是随着元素原子序数的递增
A.元素的相对原子质量逐渐增大
B.核外电子排布呈周期性变化
C.原子半径呈周期性变化
D.元素主要化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于碱金属元素和卤素的说法中,错误的是( )
A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大
B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.溴单质与水的反应比氯单质与水的反应更剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素的性质及其递变规律正确的是
A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性从上到下依次减弱
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作正确且能达到预期目的的是( )
| 实验目的 | 操作 | |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2===CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫色是否褪去 |
| ③ | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| ④ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| ⑤ | 比较铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
| ⑥ | 比较碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO2水溶液的pH |
A.①④⑤ B.②③⑤
C.①⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
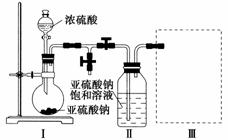
(1)装置Ⅰ中产生气体的化学方程式为________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是________________________。
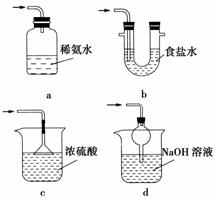
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO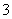 的电离程度大于水解程度,可采用的实验方法是 ________ (填序号)。
的电离程度大于水解程度,可采用的实验方法是 ________ (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
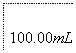

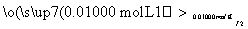 溶液出现蓝色且30 s内不褪色
溶液出现蓝色且30 s内不褪色
(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下图海水综合利用的工业流程图,判断下列说法正确的是( )

已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等.
|
| A. | 氯碱工业中电解饱和食盐水是一个将化学能转化为电能的过程 |
|
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 |
|
| C. | 在过程④、⑥反应中每氧化0.2 mol Br﹣ 需消耗0.1mol Cl2 |
|
| D. | 过程⑤在生产中无需解决其对金属设备的腐蚀问题 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com