
【题目】下列关于碳和碳的化合物的结构和性质中
(1)和碳同一主族的硅原子中能量最高的电子处在______电子层上(填写电子层符号),最外层有___种运动状态不同的电子,碳原子核外有______种能量不同的电子,有______种不同形状的电子云.
(2)1个C原子的单键氢化物分子是CH4,2个C原子的单键氢化物分子则为C2H6.以下各对分子间不存在类似关系的是_________
A.NH3与N2H4 B.H2O与H2O2 C.SF6与S2F10 D.SCl4与S2Cl2
(3)金刚石的熔点低于石墨,原因可能是________
A.石墨中还有范德华力
B.石墨熔化也要破坏共价键,且键长更短
C.石墨热稳定性更好
(4)已知常温下,H2CO3:Ki1=4.3x10﹣7、Ki2=5.6x10﹣11.结合H+的能力Na2CO3溶液______(填”>”、”<”或“=”)NaHCO3溶液,设计简单实验证明:______.
(5)在1L 0.3mol/L的NaOH溶液中,通入4.48LCO2(标准状况),反应后所得溶液中离子的浓度之间有一些等量关系,例如:.c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣),另外对此溶液中存在的离子按浓度由大到小排序为______.
【答案】M 4 3 2 D B > 取等浓度等体积的NaHCO3和Na2CO3溶液混于同一烧杯中,加入稀盐酸,边滴边搅拌,若一段时间无气泡,则Na2CO3结合H+能力强 c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+)
【解析】
(1)离核越远电子的能量越高,Si原子最外层含有4个电子;碳原子核外电子填充在三个轨道内,s轨道为球形,p轨道为纺锤形;
(2)根据两个中心原子形成一条共价单键,相应的减少2个H或F或Cl原子分析,2个中心原子结合的原子(H、F、Cl)数等于一个中心原子的2倍﹣2;
(3)石墨与金刚石在熔化时破坏共价键,共价键键长越短,键能越大,共价键越稳定,熔点越高,据此分析;
(4)电解质越弱,其相应的阴离子结合质子能力越强,常温下,H2CO3:Ki1=4.3x10﹣7>Ki2=5.6x10﹣11,电离强弱顺序是碳酸的一级电离大于其二级电离,即结合H+的能力Na2CO3溶液大于NaHCO3溶液,根据同浓度的两溶液与盐酸反应生成气体的速率进行设计实验证明;
(5)n (CO2)=![]() =0.2mol、n(NaOH)=0.3mol/L×1L=0.3mol,则反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,由于2>
=0.2mol、n(NaOH)=0.3mol/L×1L=0.3mol,则反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,由于2>![]() =
=![]() >1,所以反应后产物为Na2CO3和NaHCO3,设所得产物中含Na2CO3为xmol,NaHCO3为ymol,则:x+y=0.1、2x+y=0.3,解得:x=0.1、y=0.1,在含等物质的量的碳酸钠、碳酸氢钠的溶液中,碳酸根离子水解大于碳酸氢根离子的水解,水解使溶液显碱性,以此来解答。
>1,所以反应后产物为Na2CO3和NaHCO3,设所得产物中含Na2CO3为xmol,NaHCO3为ymol,则:x+y=0.1、2x+y=0.3,解得:x=0.1、y=0.1,在含等物质的量的碳酸钠、碳酸氢钠的溶液中,碳酸根离子水解大于碳酸氢根离子的水解,水解使溶液显碱性,以此来解答。
(1)离核越远电子的能量越高,Si原子核外电子分三层排布,最外层为M层,则能量最高的电子处在M层上,Si原子最外层含有4个电子,4个电子的运动状态均不同,所以最外层有4种运动状态不同的电子;碳原子核外电子填充在三个轨道内,三个轨道上的电子各不相同,所以碳原子核外有3种能量不同的电子,s轨道为球形,p轨道为纺锤形,则有2种不同形状的电子云;
(2)A.每个N原子能形成3条单键,两个N原子形成N﹣N,氢原子减少2个,2×3﹣2=4,故A正确;
B.一个O原子形成两条单键,两个O原子形成O﹣O单键,氢原子减少2个,2×2﹣2=2,故B正确;
C.一个S原子形成6条单键,两个S原子形成了S﹣S单键,F原子减少2个,2×6﹣2=10,故C正确;
D.在SCl4中一个S原子形成4条单键,2×4﹣2=6,两个S形成S﹣S单键所得到的分子式应为S2Cl6,故D错误;
答案选D;
(3)石墨与金刚石在熔化时破坏共价键,共价键键长越短,键能越大,共价键越稳定,熔点越高,石墨中共价键的键长比金刚石中共价键键长短,键能更大,所以石墨的熔点比金刚石的高,故答案选B;
(4)电解质越弱,其相应的阴离子结合质子能力越强,常温下,H2CO3:Ki1=4.3x10﹣7>Ki2=5.6x10﹣11,电离强弱顺序是:碳酸的一级电离大于其二级电离,即结合H+的能力Na2CO3溶液大于NaHCO3溶液,取等浓度等体积的NaHCO3和Na2CO3溶液混于同一烧杯中,加入稀盐酸,边滴边搅拌,若一段时间无气泡,则Na2CO3结合H+能力强;
(5)n (CO2)=![]() =0.2mol、n(NaOH)=0.3mol/L×1L=0.3mol,则反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,根据2>
=0.2mol、n(NaOH)=0.3mol/L×1L=0.3mol,则反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,根据2>![]() =
=>1可知反应后产物为:Na2CO3和NaHCO3,设所得产物中含Na2CO3为xmol,NaHCO3为ymol,则:x+y=0.1、2x+y=0.3解得:x=0.1、y=0.1,在含等物质的量的碳酸钠、碳酸氢钠的溶液中,c(Na+)最大,碳酸根离子水解大于碳酸氢根离子的水解,则c(HCO3﹣)>c(CO32﹣),水解使溶液显碱性,则c(OH﹣)>c(H+),显性离子大于隐性离子,则:c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+),所以离子浓度大小为:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业冶炼钛的第一步反应为:TiO2(s)+2C(s)+2Cl2![]() TiCl4(g)+2CO。下列关于该反应的说法正确的是( )
TiCl4(g)+2CO。下列关于该反应的说法正确的是( )
A.TiCl4既是氧化产物又是还原产物
B.氧化剂与还原剂的物质的量之比为1:1
C.当转移电子数目为0.2NA时,气体体积增大1.12L
D.当有26g固体参加反应时,转移电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温、催化剂条件下,某反应达到平衡,平衡常数K=![]() 恒容时,温度升高,H2浓度减小.下列说法正确的是( )
恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A. 该反应的焓变为负值
B. 2CO2(g)+2H2(g)2CO(g)+2H2O(g) 的平衡常数K1=K2
C. 升高温度,正反应速率增大,逆反应速率减小,平衡正向移动
D. 若恒容、恒温下充入CO,则K值变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出或完成下列热化学方程式。
(1)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ 的热量。写出CH4燃烧的热化学方程式__________。
(2)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。下表是一些化学键的键能。
化学键 | C-H | C-F | H-F | F-F |
键能kJ/mol | 414 | 489 | 565 | 155 |
根据键能数据估算下列反应:CH4(g) + 4F2(g)=CF4(g) + 4HF(g)的反应热△H为_____。
(3)1840年瑞士的化学家盖斯(Hess)在总结大量实验事实(热化学实验数据)的基础上提出:“定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。”
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
请写出CO还原FeO的热化学方程式:______。
(4)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为__________;
②氢气燃烧热的热化学方程式为________;
(5)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1。
则ΔH2=_______kJ·mol-1;
(6)白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH为_____。
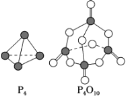
(7)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(红磷,s)+5/4O2(g)=1/4P4O10(s) ΔH2=-738.5 kJ·mol-1
相同状况下,能量较低的是________;白磷的稳定性比红磷________(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集强氧化性、吸附、絮凝于一体的新型多功能处理剂,其生产工艺如图所示:
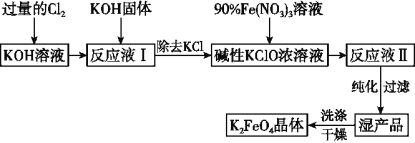
已知K2FeO4具有下列性质:
①可溶于水、微溶于浓KOH溶液
②在0~5 ℃、强碱性溶液中比较稳定
③在Fe3+和Fe(OH)3催化作用下发生分解
④在酸性至碱性条件下,能与水反应生成Fe(OH)3和O2
请完成下列填空:
(1)已知Cl2与KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,生产KClO应在温度___________的情况下进行(填“较高”或“较低”)。
(2)生产K2FeO4的反应原理是:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O(未配平),则该反应中氧化剂与还原剂的物质的量之比为______________。
(3)K2FeO4在弱碱性条件下能与水反应生成Fe(OH)3和O2,则该反应的化学方程式为________________。
(4)在“反应液Ⅰ”中加KOH固体的目的是___________。
A. 为下一步反应提供反应物
B. 与“反应液Ⅰ”中过量的Cl2继续反应,生成更多的KClO
C. KOH固体溶解时会放出较多的热量,有利于提高反应速率
D. 使副产物KClO3转化为KCl
(5)制备K2FeO4时,须将90%的Fe(NO3)3溶液缓慢滴加到碱性的KClO浓溶液中,并且不断搅拌。采用这种混合方式的原因是_______________________ (答出1条即可)。
(6)从“反应液Ⅱ”中分离出K2FeO4晶体后,可以得到的副产品有________ (写化学式)。
(7)工业上常用“间接碘量法”测定高铁酸钾样品中高铁酸钾的含量,其方法是:用碱性的碘化钾溶液(pH为11~12)溶解3.96 g高铁酸钾样品,调节pH为1,避光放置40分钟至反应完全(高铁酸根离子全部被还原成铁离子),再调节pH为3~4(弱酸性)。以1.0 mol/L的硫代硫酸钠标准溶液为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),当达到滴定终点时,用去硫代硫酸钠标准溶液15.00 mL,则原高铁酸钾样品中高铁酸钾的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常数可用NA表示,下列叙述中正确的是( )
A.1mol H2O所含的原子数为NA个
B.16g O2-含有的电子数为10NA个
C.常温常压下,11.2L Cl2所含分子数为0.5NA个
D.1L 1mol/L NaClO溶液中含ClO-个数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从宏观现象探究微观本质是重要的化学学科素养。以亚硫酸纳(Na2SO3)为实验对象,探究其性质。实验如下:
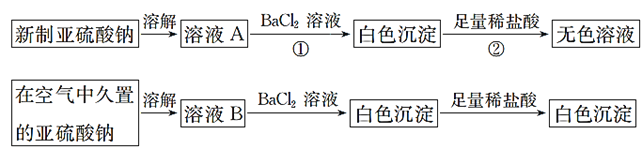
(1)写出上述实验中②的离子方程式:__________。
(2)通过上述实验可知,在空气中久置的亚硫酸纳固体中会混有____________ (填化学式)。
(3)亚硫酸纳晶体样品若变质,下列说法错误的是 _______________。
A.晶体表面变黄 B.其水溶液pH 将减小 C.其样品质量将增加
(4)将碳酸纳溶液加热到40 ℃通入二氧化硫饱和后,再加入等量的碳酸钠溶液,在避免与空气接触的情况下结晶可制得亚硫酸钠,该制备过程总反应的化学方程式 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
A. 前2 min,D的平均反应速率为0.2 mol·L-1·min-1 B. 此时,B的平衡转化率是40%
C. 升高该体系的温度,化学平衡常数不变 D. 增加C,逆向速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如下:
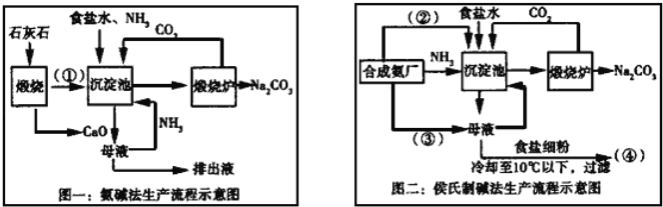
完成下列填空:
(1)写出化学式:②_____、③____
(2)从理论上分析,氨碱法生产过程中_____(选填“需要”、“不需要”)补充氨气,写出该工艺中生成CaCl2的化学方程式________________。
(3)对联碱法中从母液中提取氯化铵晶体的过程进行分析,所得结论合理的是______。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气可把碳酸氢钠转化为碳酸钠,防止碳酸氢钠析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(4)取“侯氏制碱法”生产的纯碱样品5.500g,配成500mL溶液,取25mL溶液用0.1000mol/L的标准盐酸滴定(设其中的杂质不与盐酸反应),用酚酞作指示剂,三次滴定消耗盐酸的平均量为25.00mL.计算样品中纯碱的质量分数______。(已知25℃时0.1mol/L的NaHCO3溶液的pH约为8.3)某活动小组根据上述制碱原理,用如下所示装置(夹持装置省略)制备碳酸氢钠.
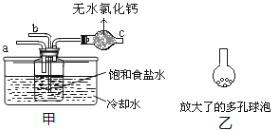
(5)实验时,须先从____管通入_____气体,再从_____管中通入_____气体。
(6)有同学建议在甲装置的b管下端连接乙装置,目的是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com