
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)  2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A 该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B 因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行
C根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol·L-1)3
D达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
C、N、O、Na、Al、S、Cl是常见的元素
(1)C元素位于元素周期表的位置 ;C元素的一种同位素可以测定文物年代,这种同位素的符号为 。
(2)用“>”、“<”或“=”填空
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- Al3+ | H2SO4 HClO4 | O2- S2- | 35Cl 37Cl |
(3)黑火药爆炸时发生反应的化学方程式为:S+2KNO3 +3C==K2S +3CO2↑+N2↑反应生成物中,属于非电解质的是_______(写结构式);其中熔点最高的物质的电子式是_________。
(4)在(3)中化学反应方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_________,能证明其递变规律的事实是( )(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
已知当NH4Cl溶液的浓度小于0.1 mol·L-1时,其pH>5.1。现用0.1 mol·L-1的盐酸滴定10 mL 0.05 mol·L-1的氨水,用甲基橙作指示剂达到终点时所用盐酸的量应是( )
A.10 mL B.5 mL C.大于5 mL D.小于5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
水的电离平衡曲线如图所示:
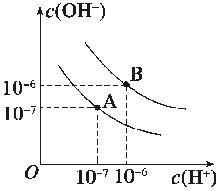
(1)若以A点表示25℃时水电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从______增加到________。
(2)将pH=8的氢氧化钡溶液与pH=5的盐酸溶液混合并保持100℃恒温,欲使混合溶液的pH=7,则氢氧化钡溶液与盐酸的体积比为________。
(3)已知AnBm的离子积K=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)和c(Bn-)表示离子的物质的量浓度。在某温度下,氢氧化钙溶解度为0.74 g,其饱和溶液密度设为1 g/cm3,其离子积为K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l )=2CO2 (g )+3N2 (g )+4H2O (l ) (Ⅰ)
(1)若将反应(Ⅰ)设计成原电池,则正极的电极反应式为
(酸性电解质)。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是________.
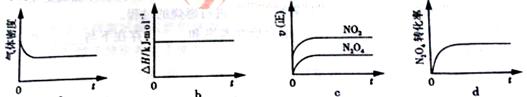
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或
“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数
Kb=2×10—5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇: CO(g)+2H2(g)  CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是
CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是
A.T1>T2
B.该反应的△H >0
C.T1时的平衡常数K1> T2时的平衡常数K2
D.T1时的平衡常数K1< T2时的平衡常数K2
查看答案和解析>>
科目:高中化学 来源: 题型:
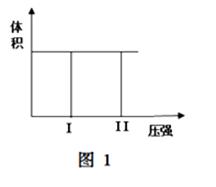
( I) 在一个容积固定不变的密闭容器中进行反应:
2X(g) + Y(g)  2Z(g) 若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0; ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。
2Z(g) 若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0; ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,
pC(g) ,
在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如
下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
⑴当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
⑵维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol.
⑶当压强为1×106 Pa时,此反应的平衡常数表达式: 。
⑷其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。
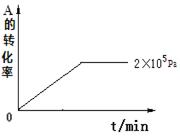
查看答案和解析>>
科目:高中化学 来源: 题型:
水的电离过程为H2O
 H++OH-,在不同温度下其平衡常数为:K(25℃)=1.0×10-14 mol2·L-2,K(35℃)=2.1×10-14 mol2·L-2。则下列叙述不正确的是( )
H++OH-,在不同温度下其平衡常数为:K(25℃)=1.0×10-14 mol2·L-2,K(35℃)=2.1×10-14 mol2·L-2。则下列叙述不正确的是( )
A.纯水的pH随着温度的升高而降低
B.在35℃时,[H+]>[OH-]
C.在25℃和35℃时,[H+]=[OH-]
D.水的电离是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)
 Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的( )
Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的( )
A.MgCl2 B.NaOH C.MgSO4 D.NaHSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com