
如图是检验某无色气体A是SO2和CO2的混合气体的装置图,按要求回答下列问题。
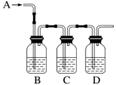
(1)B中加入的试剂是________,作用是______________________________________________。
(2)C中加入的试剂是__________,作用是__________________________________________。
(3)D中加入的试剂是________,作用是___________________________________________。
(4)实验时,C中应观察到的现象是______________________________________。
科目:高中化学 来源: 题型:
右
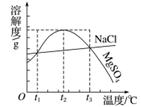
图是NaCl、MgSO4的溶解度曲线。下列说法正确的是( )
A.只有在t1 ℃时,NaCl和MgSO4的溶解度才相等
B.t1~t2 ℃,MgSO4的溶解度随温度升高而减小
C.在t2 ℃时,MgSO4饱和溶液的溶质质量分数最大
D.把MgSO4饱和溶液的温度从t3 ℃降至t2 ℃时,没有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于晶体的说法中,正确的是( )
A.在晶体中只要有阴离子就一定有阳离子 B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高 D.分子晶体的熔点一定比金属晶体的低
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2∶1。请回答下列问题:
(1)A单质、B单质、化合物R的熔点大小顺序为下列的________(填序号)。
①A单质>B单质>R ②R>A单质>B单质
③B单质>R>A单质 ④A单质>R>B单质
(2)在CB3分子中C元素原子的原子轨道发生的是______杂化,其固体时的晶体类型为________。
(3)写出D原子的核外电子排布式:______________________________。C的氢化物比D的氢化物在水中的溶解度大得多的可能原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊溶液褪色
B.能使品红溶液褪色的物质不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,但原理不都相同
D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
查看答案和解析>>
科目:高中化学 来源: 题型:
以下每个选项中的两组物质都能反应,且能放出同一种气体的是( )
A.铜与稀硫酸,铜与浓硫酸
B.铁与稀硫酸,铁与浓硫酸
C.硫化钠与稀硫酸,亚硫酸钠与稀硫酸
D.硫化钠与稀硫酸,硫化钠与稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 制得。实验室模拟该工业过程的装置如图所示。回答下列问题:
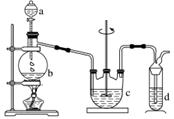
(1)b中反应的离子方程式为_______________________________________________________,
c中试剂为____________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是____________。
(3)d中的试剂为______________。
(4)实验中要控制SO2生成速率,可以采取的措施有
________________________________________________________________________
__________________________________________________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的pH=1。下列叙述不正确的是( )
A.反应中共消耗1.8 mol H2SO4
B.气体甲中SO2与H2的体积比为4∶1
C.反应中共消耗97.5 g Zn
D.反应中共转移1.5 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com