
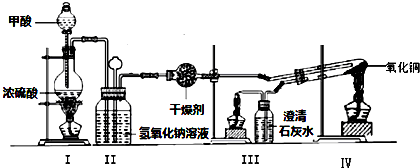
分析 (1)甲酸在浓硫酸条件下能分解生成CO和H2O,体现浓硫酸具有脱水性;
(2)氢氧化钠溶液吸收酸性气体;CO加热容易发生爆炸危险,需要排尽装置中空气,还原氧化铜之前需要检验纯度;
(3)干燥管中的固体颗粒堵塞干燥管的出口,装置Ⅱ装置气压增大,将溶液压入长颈漏斗中;
(4)若生成CO,CO与CuO反应生成Cu与二氧化碳,二氧化碳与石灰水反应生成碳酸钙沉淀;
(5)尾气中CO需要燃烧处理,还要防止石灰水倒吸;
(6)Cu与稀硫酸不反应,而Cu2O与稀硫酸反应得到Cu与硫酸铜,溶液呈蓝色.
解答 解:(1)甲酸在浓硫酸条件下能分解生成CO和H2O,体现浓硫酸具有脱水性,
故选:B;
(2)氢氧化钠溶液洗气,除去酸性气体;CO加热容易发生爆炸危险,需要排尽装置中空气,实验步骤③某项操作是指:检验CO的纯度,
故答案为:洗气,除去酸性气体;检验CO的纯度;
(3)干燥管中的固体颗粒堵塞干燥管的出口,装置Ⅱ装置气压增大,则装置Ⅱ中出现的现象为:长颈漏斗中液面上升,
故答案为:长颈漏斗中液面上升;
(4)若生成CO,CO与CuO反应生成Cu与二氧化碳,二氧化碳与石灰水反应生成碳酸钙,装置IV中黑色固体变红,装置Ⅲ中的澄清石灰水变浑浊,
故答案为:装置IV中黑色固体变红,装置Ⅲ中的澄清石灰水变浑浊;
(5)尾气中CO需要燃烧处理,还要防止石灰水倒吸,实验步骤④中酒精灯的熄灭顺序为:IV、I、Ⅲ,
故答案为:IV、I、Ⅲ;
(6)Cu与稀硫酸不反应,而Cu2O可与稀硫酸溶液反应生成Cu2+,会使溶液变蓝,观察溶液颜色的变化可以判断生成物,
故答案为:合理;因为Cu2O可与稀硫酸溶液反应生成Cu2+,会使溶液变蓝.
点评 本题考查物质制备实验,涉及对原理、装置、操作与实验方案分析评价等,注意实验中渗透环保意识与安全意识,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
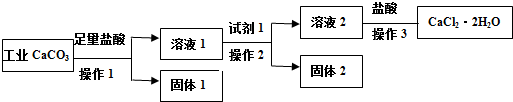
| A. | 试剂1可以是适量的氢氧化钙固体或适量的氧化钙固体 | |
| B. | 欲检验溶液2中是否含有Fe3+,可取少量溶液,滴加KSCN溶液,若溶液无明显现象,则不含有Fe3+ | |
| C. | 若用已知浓度AgNO3溶液来滴定产品(加入某指示剂)中的氯离子来测量产品纯度,计算所得的数据不可能大于100.0% | |
| D. | 若改变方案,在溶液2中加入适量的碳酸铵,得到的沉淀用盐酸溶解、酸化后进行操作3,可得到纯度更高的二水合氯化钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,向醋酸钠溶液中滴加盐酸至溶液呈中性一定有:c(CH3COOH)=c(Cl-) | |
| B. | NaHSO4溶液中滴加Ba(OH)2至溶液恰好呈中性c(Na+)>c(SO42-)>c(OH-)=c(H+) | |
| C. | 某酸式盐NaHA溶液中一定有:c(OH-)+c(A2-)=c(H+)+c(H2A) | |
| D. | 0.5 mol/L 的Na2S溶液中:$\frac{1}{2}$ c(Na+)=c(H2S)+c(HS-)+c(S2-)=0.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-物质的量为0.1mol | B. | Cl-物质的量浓度为0.2 mol•L-1 | ||
| C. | Ba2+物质的量为0.1mol | D. | Ba2+物质的量浓度为0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:甲>乙 | |
| B. | 原子核外电子层数:乙<丁 | |
| C. | 原子最外层电子数:丙>丁>戊 | |
| D. | 元素的最高价氧化物对应水化物的酸性:丙<戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
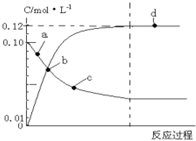 373K时,N2O4(g)?2NO2(g)平衡体系的建立过程中各物质浓度与时间的关系如图,下列说法正确的是( )
373K时,N2O4(g)?2NO2(g)平衡体系的建立过程中各物质浓度与时间的关系如图,下列说法正确的是( )| A. | 反应达到a点时,正反应速率大于逆反应速率 | |
| B. | 反应达到b时,表示反应达到平衡 | |
| C. | 反应达到b点时,NO2和 N2O4二者浓度相等 | |
| D. | 反应达到d点时,N2O4的转化率为40% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com