
常温下,一定浓度的某酸HA溶液的pH=5,下列有关说正确的是
A. 向溶液中加入适量NaA固体,若溶液pH不变,则HA为强酸
B. 若HA为弱酸,则该溶液导电能力比等体积pH=5的盐酸弱得多
C. 若HA为弱酸,则加入等体积pH=9的NaOH溶液,所得溶液pH>7
D. 取该溶液1.00mL,加水稀释至1000mL,所得溶液pH=8
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:推断题
F(4-苯井呋喃乙酸)是合成神经保护剂那朵林的中间体,某种合成路线如下:
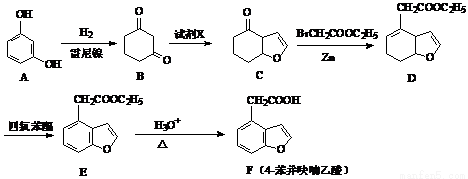
(1)化合物F中的含氧官能团为________和___________(填官能团的名称)
(2)试剂X分子式为C2H3OCl且分子中既无甲基也无环状结构,则X的结构简式为__________;由E→F的反应类型为__________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式_________。
Ⅰ. 能发生银镜反应 Ⅱ. 分子中含有1个苯环且有3种不同化学环境的氢
(4)请写出以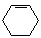 和BrCH2COOC2H5为原料制备
和BrCH2COOC2H5为原料制备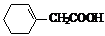 的合成路线流程图 (无机试剂可任选)。合成路线流程图示例如下:
的合成路线流程图 (无机试剂可任选)。合成路线流程图示例如下:
CH3CHO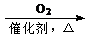 CH3COOH
CH3COOH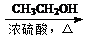 CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第二次模考化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A. 加热坩埚中的硫酸铜晶体,失水后须在干燥器中冷却,再称量
B. 检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2悬浊液并加热
C. 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低
D. 做锌铜稀硫酸原电池实验时,反应一段时间后锌片表面还是呈银白色
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:填空题
氮是一种重要的元素,其对应化合物在生产生活中有重要的应用。
(1)氮化铝(AlN)可用于制备耐高温的结构陶瓷,遇强碱会腐蚀,写出AlN与氢氧化钠溶液反应的离子方程式_______________。
(2)氨是制备氮肥、硝酸等的重要原料②③
①己知:N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
N2(g)+O2(g)  2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
2H2(g)+O2(g)  2H2O(1) △H= -571.6 kJ/mol
2H2O(1) △H= -571.6 kJ/mol
试写出表示氨的标准燃烧热的热化学方程式________________。
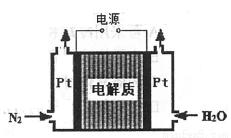
②某电解法制氨的装置如右图所示,电解质只允许质子通过,试写出阴极的电极反应式__________。
(3)反应:2NO(g)+O2(g) 2NO2(g)△H<0是制备硝酸过程中的一个反应。
2NO2(g)△H<0是制备硝酸过程中的一个反应。
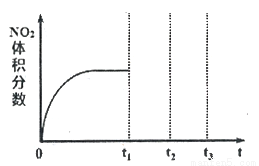
①将NO和O2按物质的量之比为2:1置于恒温恒容密闭容器中进行上述反应,得到NO2体积分数与时间的关系如下图所示。保持其它条件不变,t1时再向容器中充入适量物质的量之比为2:1的NO和O2的混合气体,t2时再次达到平衡,请画出tl-t3时间范围内NO2体积分数随时间的变化曲线:____________。
②在研究此反应速率与温度的关系时发现,NO转化成NO2的速率随温度升高反而减慢。进一步研究发现,上述反应实际是分两步进行的:
I 2NO(g)  N2O2(g) △H<0
N2O2(g) △H<0
II N2O2(g)+O2(g)  2NO2(g) △H<0
2NO2(g) △H<0
已知反应I能快速进行,试结合影响化学反应速率的因素和平衡移动理论分析,随温度升高,NO转化成NO2的速率减慢的可能原因________。
(4)已知常温下,Ka(CH3COOH)=Kb(NH3·H2O)=l.8×l0-5。则常温下0.lmol/L的CH3COONH4溶液中,(CH3COO-):c(NH3·H2O)=________________。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:选择题
常温下,0.2 moI·L-l的Na2CO3溶液与0.2 moI·L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是
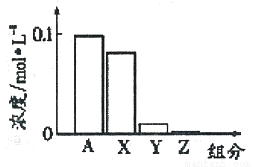
A. A代表Na+浓度
B. 该溶液中c(OH-)>c(Y)
C. 向该溶液中加水稀释,所有离子浓度均减小
D. 该混合溶液中:c(X)+c(Y)+c(Z)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A. 氯气和水反应:Cl2+H2O= 2H++Cl-+ClO-
B. 金属钠投入MgCl2溶液中:2Na+Mg2+ =2Na++Mg
C. 0.lmol/LNaHSO4溶液与0.lmol/LBa(OH)2溶液等体积混合:SO42-+Ba2+=BaSO4↓
D. 硅酸钠水溶液中通入过量CO2:SiO32-+2H2O+2CO2=2HCO3-+H2SiO3↓
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. 食盐和醋可作调味剂,也可用作食品防腐剂 B. 植物秸秆不可用来制造酒精
C. 镁合金可用于制造火箭、导弹和飞机的部件 D. 二氧化硅可用于制光导纤维
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一下学期开学考试化学试卷(解析版) 题型:选择题
为了使Fe(OH)2氧化成Fe(OH)3,而不引入杂质,应向悬浊液中加入( )
A. H2O2 B. HNO3 C. 氯水 D. Na2O2
查看答案和解析>>
科目:高中化学 来源:辽宁省大连市2017届高三3月双基测试化学试卷 题型:填空题
【化学——物质结构与性质】
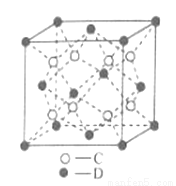
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个电子;C的基态原子2p能级有1个电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)写出基态E原子的价电子排布式________。基态A原子的第I电离能比B的大,其原因是____。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是_________。
(3)A的最简单氢化物分子的空间构型为___________,其中A原子的杂化类型是_________。
(4)向E的硫酸盐溶液中通入A的气态氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出蓝色晶体。
①该蓝色晶体的化学式为_________,加入乙醇的目的是____________。
②写出该配合物中配离子的结构简式___________。
(5)C和D形成的化合物的晶胞结构如图所示,则D的配位数是_______,已知晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,求晶胞边长a=________cm(含用ρ、NA的计算式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com