
 2NH3(g)△H=-92.4kJ/mol)
2NH3(g)△H=-92.4kJ/mol)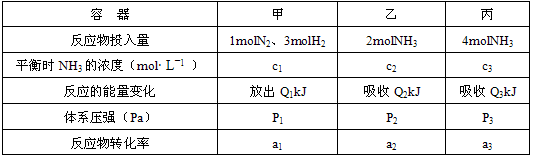
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
| 编号 | 起始状态(mol) | 平衡时HI的物质的量(mol) | ||
| H2 | I2 | HI | ||
| 已知 | 1 | 2 | 0 | a |
| ① | 2 | 4 | 0 | 2a 2a |
| ② | 0 0 |
0.5 0.5 |
1 | 0.5a |
| ③ | m | n(n≥2m) | (2n-4m) (2n-4m) |
n-m n-m |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温恒容的条件下,在密闭容器中按不同方式投入反应物,均达到平衡,测得平衡时的有关数据如下(已知:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1):
①c1=c2 ②c3=2c2 ③Q1=Q2 ④Q1+Q2=92.4 ⑤p1=p2 ⑥a2>a3. |
| A、①④⑤⑥ | B、①③⑤⑥ |
| C、①②③⑥ | D、②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:2009-2010学年正定中学高二下学期期末考试化学 题型:实验题
(5分)在密闭容器中投入一定量的A和B发生反应:mA(g)+nB(g)  pC(g)。
pC(g)。
(1)欲使A与B的转化率等于m:n ,则起始加入A、B的物质的量之比为
(2)充入一定量的A、B,若在不同条件下C的体积分数随时间的变化如图1—1所示,则:
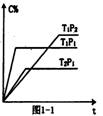
m+n p(填“>”、“<”或“=”),
T1 T2填(“>”、“<”或“=”),
该反应的△H 0(“>”、“<”或“=”)。

(3)一定条件下,从正反应开始达到化学平衡过程中,混和气体的平均相对分子质量随时间的变化如图1—2所示。若在恒温恒容的条件下,向原平衡体系中再通入一定量的C,则体系中气体的平均相对分子质量将 (填“增大”、“减小”、“不变”或“无法确定”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com