
【题目】废旧锌锰于电池内部的黑色物质A主要含有MnO2、MnOOH、NH4Cl、ZnCl2、炭粉,用A制备高纯MnCO3的流程圈如下:
![]()
(1)锌锰干电池的负极材料是__________(填化学式)。
(2)第I步操作得滤渣的成分是______;第II步在空气中灼烧的目的除了将MnOOH转化为MnO2外,另一作用是__________。
(3)步骤I中制得MnSO4溶液,该反应的化学方程式为____________。用草酸(H2C2O4)而不用双氧水(H2O2)作还原剂的原因是_________。
(4)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;Mn(OH)2开始沉淀时pH为7.7。
第IV步多步操作可按以下步骤进行:
操作l:加入NH4HCO3溶液调节溶液pH<7.7,充分反应直到不再有气泡产生;
操作2:过滤,用少量水洗涤沉淀2~3次;
操作3:检测滤液;
操作4:用少量无水乙醇洗涤2~3次;
操作5:低温烘干。
①操作1发生反应的离子方程式为_________;若溶液pH>7.7,会导致产品中混有____(填化学式)。
②操作3中,检测MnCO3是否洗净的方法是___________。
③操作4用少量无水乙醇洗涤的作用是_____________。
【答案】 Zn MnO2、 MnOOH碳粉 除去混合物中的碳粉 MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑ +2H2O 双氧水容易被MnO2催化分解(其他合理答案均可) Mn2++2HCO3-=MnCO3↓+CO2↑+H2O Mn(OH)2 取最后一次滤液,加入盐酸酸化的BaCl2溶液,若无白色沉淀产生则已洗涤干净 除去产品表面的水分,防止其在潮湿环境下被氧化,并有利于后续低温烘干
【解析】废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4Cl、MnOOH 、ZnCl2、炭粉,加水溶解、过滤、洗涤,滤液中含有NH4Cl、ZnCl2,滤渣为MnO2 、MnOOH和碳粉,加热至恒重,碳转化为二氧化碳气体,再向黑色固体中加稀硫酸和H2C2O4溶液,过滤,滤液为硫酸锰溶液,最后得到碳酸锰;
(1)碱性锌锰干电池中失电子的为负极;
(2)MnO2、MnOOH和碳粉均不能溶于水,除去碳粉可以加热;
(3)MnO2与稀H2SO4、H2C2O4反应生成硫酸锰;双氧水易分解;
(4)操作1为MnSO4溶液中加入碳酸氢钠溶液,生成MnCO3沉淀;加入NaHCO3调节pH,PH过大,容易生成Mn(OH)2沉淀;操作3主要是检验是否有SO42-离子;操作4:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,所以用无水乙醇洗涤。
(1)碱性锌锰干电池中失电子的为负极,则锌为负极,正确答案为:Zn;
(2)MnO2 、MnOOH和碳粉均不能溶于水,所以过滤得到的滤渣为MnO2、MnOOH、碳粉,在空气中灼烧的目的除了将MnOOH转化为MnO2外,另一作用是加热碳转化为二氧化碳气体,所以第Ⅱ步操作的另一作用:除去碳粉;正确答案为:MnO2、MnOOH、碳粉;除去碳粉;
(3)MnO2与稀H2SO4、H2C2O4反应生成硫酸锰,其反应的方程式为:MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑ +2H2O;过氧化氢易分解,尤其是在MnO2催化作用下更易分解,所以不宜用过氧化氢为还原剂;正确答案为:MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑ +2H2O;双氧水容易被MnO2催化分解;
(4)①操作1:MnSO4溶液中加入碳酸氢钠溶液,调节pH小于7.7,生成MnCO3沉淀;反应的离子方程式:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,如果PH大于7.7,溶液中Mn2+容易生成Mn(OH)2沉淀,使产品不纯;正确答案为: Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;Mn(OH)2;
②MnSO4溶液中加入碳酸氢钠溶液,生成MnCO3沉淀和硫酸钠,过滤,洗涤,沉淀是否洗涤干净主要检测洗涤液中是否含有硫酸根离子,所以其方法是:取最后一次洗涤液,加入盐酸酸化的BaCl2溶液,若无白色沉淀产生则已洗涤干净,正确答案:取最后一次洗涤液,加入盐酸酸化的BaCl2溶液,若无白色沉淀产生则已洗涤干净;
③操作4:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,则洗涤沉淀时不能用水,所以用无水乙醇洗涤,乙醇易挥发,除去产品表面的水分,同时防止MnCO3在潮湿环境下被氧化,也有利于后续低温烘干,正确答案:除去产品表面的水分,防止其在潮湿环境下被氧化,并有利于后续低温烘干。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】25℃时,相同体积和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如图所示.下列说法正确是( ) 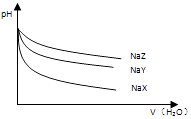
A.在上述三种盐原溶液中,水的电离程度大小是NaX>NaY>NaZ
B.在等物质的量浓度的NaX、NaY、NaZ混合液中,离子浓度的大小关系是c(Z﹣)>c(Y﹣)>c(X﹣)
C.在上述NaX和NaY的混合液中存在 ![]() =
= ![]()
D.在0.2molL﹣1 NaX溶液中加 入等体积0.1molL﹣1的盐酸,所得混合液中存在c(H+)+c(HX)=c(OH﹣)+c(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有化学反应A(g)+B(g)=AB(g)H(反应过程如曲线1所示),当反应体系中加入物质K后反应分两步进行(反应过程如曲线2所示):
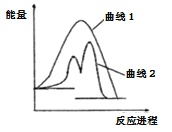
①A(g)+K(g)=AK(g)H1 ②AK(g)+B(g)=AB(g)+K(g)H2,根据图像分析,下列说法正确的是
A. 反应过程中AK(g)是催化剂 B. 加入催化剂会降低反应的H
C. H>0 D. lmolA(g)和1molB(g)的总能量高于1molAB(g)的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们习惯上把电解饱和食盐水的工业叫做氯碱工业. 如图表示电解饱和NaCl溶液的装置,X、Y是石墨棒.实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题: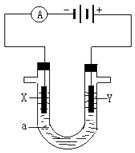
①X极上的电极反应式是 , 在X极附近观察到的现象是;
②Y电极上的电极反应式是 , 检验该电极反应产物的方法是 .
③电解NaCl溶液的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三元电池成为2018年我国电动汽车的新能源,其电极材料可表示为![]() ,且x+y+z=1.充电时电池总反应为LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
,且x+y+z=1.充电时电池总反应为LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
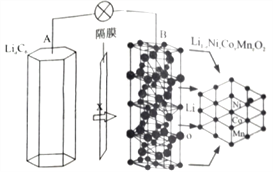
A. 允许离子X通过的隔膜属于阴离子交换膜
B. 充电时,A 为阴极,Li+被氧化
C. 可从无法充电的废旧电池的石墨电极中回收金属锂
D. 放电时,正极反应式为 Li1-aNixCoyMnzO2+aLi ++ae-= LiNixCoyMnzO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A.甲烷的燃烧热ΔH=-890.3 kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1 , 则H2SO4和Ca(OH)2反应的中和热ΔH=2x(-57.3)kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含锰废料(主要成分MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)与烟气脱硫进行联合处理并制备MnSO4的流程如下:
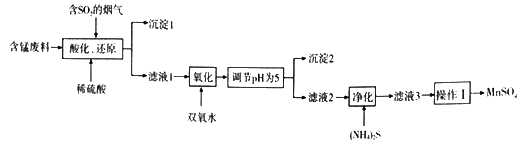
已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如下表所示。
氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
Ksp | 1.3×10-33 | 4.0×10-38 | 2.2×10-20 | 1.9×10-14 |
请回答:
(1)沉淀1的化学式为__________________。
(2)室温下,调节pH为5.试通过计算说明此时Al3+、Fe3+已沉淀完全,理由是_________。(NH4)2S的电子式为________________;“净化”时,加入(NH4)2S的作用为___________________。
(3)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为__________________。
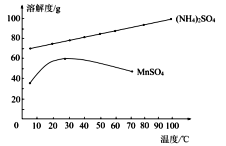
(4)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4。(NH4)2SO4、MnSO4的溶解度曲线如下图所示。
据此判断,操作“I”应为蒸发浓缩、____________、洗涤、干燥。
(5)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为________________。
(6)25.35 g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
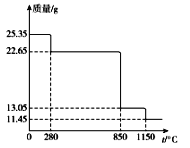
①300℃时,所得固体的化学式为______________________。
②1150℃时,反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的某可逆反应,其正反应速率υ(正)和逆反应速率υ(逆)随时间的变化如图所示,下列判断正确的是( )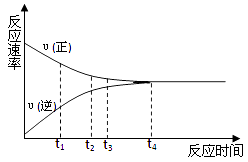
A.t1时刻,υ(正)< υ(逆)
B.t2时刻,υ(正)> υ(逆)
C.t3时刻,υ(正)= υ(逆)
D.t4时刻,υ(正)= υ(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com