
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。
(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为___________________________;向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是 。
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
(3)电解法是目前研究最为热门的生产ClO2的方法之一。如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。
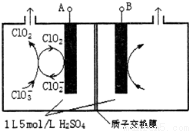
①电源负极为___________________极(填A或B)
②写出阴极室发生反应的电极反应式和离子方程式
_______________________ ___ ; 。
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2—歧化反应。若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为_________________。
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源:2015-2016学年海南嘉积中学高二下期中理科化学试卷(解析版) 题型:选择题
下列有机物在核磁共振氢谱上只给出一组峰的是
A .HCHO B .CH3OH C.HCOOH D.CH3COOCH3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:实验题
化工原料红矾钠(重铬酸钠:Na2Cr2O7•2H2O)主要是以铬铁矿(主要成份为 FeO•Cr2O3,还含有A12O3、SiO2 等杂质)为主要原料生产,其主要工艺流程如下:
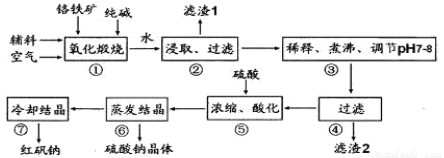
步骤①中主要反应的化学方程式为:4FeO•Cr2O3+8Na2CO3+7O2 =8Na2CrO4+2Fe2O3+8CO2
(1)杂质 A12O3、SiO2在①中转化后经加水过滤进入滤液,写出 A12O3在①中转化的化学反应方程式____________________________________。
(2)用化学平衡移动原理说明③中煮沸的作用是____________(用离子方程式结合文字说明)
(3)⑤中酸化是使 CrO42一转化为 Cr2O72一,若1L酸化后所得溶液中含铬元素的质量为 28.6 g,CrO42-有 转化为 Cr2O72-。
转化为 Cr2O72-。
①酸化后所得溶液中 c(Cr2O72- )=________
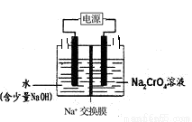
②工业上也可设计图示装置(两极均为惰性电极)电解Na2CrO4溶液制取 Na2Cr2O7,图中右侧电极的电极反应式为_________________________。若电解前两侧溶液的质量相等,则当电解过程中转移了1mol 电子时两侧溶液的质量差为______________g
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:选择题
已知一定条件下体积不变的密闭容器中(各物质均为气态),1 mol N2和3 mol H2充分反应生成 NH3放热为Q1 kJ,下列说法正确的是
A.上述反应的热化学方程式为:N2(g)+3H2(g)  2NH3(g) ΔH=- Q 1 kJ/mol
2NH3(g) ΔH=- Q 1 kJ/mol
B.相同条件下1 mol N2 (g)和 3 mol H2(g) 的总键能小于2molNH3(g)的总键能
C.相同条件下将2 molN2 和6molH2置于相同容器中充分反应后放出的热量为 Q 2 kJ,Q2 =2Q1
D.相同条件下气体密度不变时,可以判断反应 N2(g)+3H2 (g) 2NH3 (g)达到平衡状态
2NH3 (g)达到平衡状态
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:选择题
设N A为阿伏加德罗常数的值,下列叙述正确的是
A.60gSiO 2晶体有σ键4N A
B.在标准状况下,2.24 LSO3中含有的氧原子数为0.3NA
C.t℃时,MgCO3的 Ksp=4×10-6,则饱和溶液中含 Mg2+数目为2×10-3NA
D.标准状况下,2.24LCl2通入足量H2O溶液中转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2016届宁夏石嘴山三中高三下四模理综化学试卷(解析版) 题型:选择题
利用如图所示装置进行下列实验,不能得出相应实验结论的是
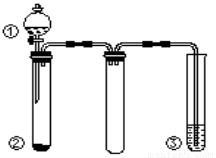
选项 | ① | ② | ③ | 实验结论 |
A | 浓硝酸 | Fe | NaOH溶液 | 说明铁和浓硝酸反应可生成NO2 |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
C | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:S>C>Si |
D | 浓氨水 | 生石灰 | 酚酞 | 氨气的水溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三下最后一次模拟理综化学试卷(解析版) 题型:填空题
【化学——选修2化学与技术】硫酸工业在国民经济中占有极其重要的地位。
(1)工业制硫酸时所用硫铁矿的主要成分为FeS2,其中硫元素的化合物为 。
(2)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有 (任写一种)。
(3)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.转化器中使用适宜的温度 D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(4)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
2SO2(g)+O2(g)  2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为 。
(5)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔))。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的。
____________________________________________________________________。
②工业生产中常用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
______________________________________________________________________
_____________________________________________________________________。
(6)实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4•7H2O),聚铁的化学式为[Fe2(OH)n(SO4)3﹣0.5n]m,制备过程如图所示,下列说法正确的是 。
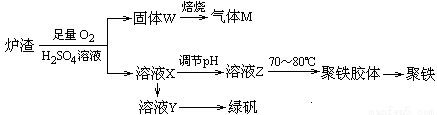
A.炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+═4Fe3++4S↓+6H2O
B.气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C.向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再将溶液Y蒸发结晶即可得到绿矾
D.溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三第七次模拟理综化学试卷(解析版) 题型:选择题
下列有关实验的说法正确的是
A.向蛋白质溶液中滴加饱和Na2SO4溶液或浓硝酸均会产生白色沉淀,是因为蛋白质变性
B.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
C.某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水,石灰水变浑浊,该钾盐一定是K2CO3
D.进行K与水反应的实验操作:可在培养皿中放些水,然后取绿豆大小的钾,用滤纸吸干表面的煤油,投入培养皿中
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:选择题
下列有关胶体的说法错误的是:
A.胶粒可以透过滤纸,不能透过半透膜
B.采用喷雾型药剂形成一定大小的液珠,可有效提高药物疗效
C.冶金工业的矿粒除尘利用了丁达尔效应
D.空气中的雾霾现象体现了胶体的存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com