
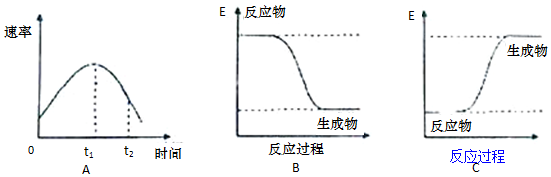
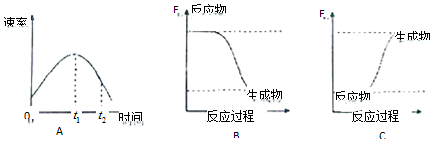
分析 (1)浓度越小,反应速率越小,温度越高,速率越大;放热反应中,反应物的总能量大于生成物的总能量,吸热反应中,反应物的总能量小于生成物的总能量;结合金属与酸的反应为放热反应分析;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算焓变=反应物总键能-生成物的总键能,以此计算反应热并判断吸热还是放热.
解答 解:(1)在烧杯中加入5mL 1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,开始时盐酸的浓度减小,速率应减小,但实际上增大,说明温度对速率的影响大于浓度对速率的影响,则该反应放热;放热反应中,反应物的总能量大于生成物的总能量,则图象B正确,
故答案为:放热;B;
(2)在反应2NH3?N2+3H2中,断裂2mol NH3,共形成6mol N-H键,吸收的能量为:6×391kJ=2346kJ,生成3mol H-H键,1mol N≡N键共放出的能量为:3×436kJ+946kJ=2254kJ,吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2346kJ-2254kJ=92kJ,所以当1molNH3分解吸收热量为46kJ;
故答案为:吸收;46.
点评 本题考查反应热与焓变的应用,为高频考点,侧重于学生的分析能力的考查,主要把握反应的特点,解题的关键是分析实验的过程,并结合题中所给的信息结合所学相关知识对问题进行探讨与分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾的主要成分是氢氧化铝 | B. | CH3OH可导致人体中毒 | ||
| C. | SO2可大量用于漂白食品 | D. | Na2CO3可以做胃药 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液呈中性 | |
| B. | 某强碱溶液的浓度为0.01 mol/L,该溶液的pH值一定为12 | |
| C. | 溶液pH值越大,氢离子浓度越大 | |
| D. | 酸性溶液中,氢离子浓度一定大于氢氧根浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇不能与NaOH溶液反应,苯酚可以与NaOH溶液反应,说明苯环对羟基产生影响 | |
| B. | 苯不能被酸性KMnO4溶液氧化,甲苯可以被酸性KMnO4溶液氧化为苯甲酸,说明侧链对苯环产生了影响 | |
| C. | 苯与苯酚与溴水反应的条件、产物区别,说明羟基对苯环产生影响 | |
| D. | 苯和甲苯硝化反应产物的区别,说明甲基对苯环产生影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH+3O2=2CO2+3H2O△H=-1367.0 kJ•mol-1 | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3 kmol-1 | |
| C. | S(s)+O2(g)=SO2(g)△H=-269.8 kJ•mol-1 | |
| D. | 2NO(g)+O2(g)=2NO2(g)△H=-116.2 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com