
A、次氯酸电子式: | ||
B、S2-的结构示意图: | ||
C、O-18的原子符号:
| ||
| D、CO2分子的结构式:O=C=O |
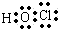 ,故A错误;
,故A错误; ,故B正确;
,故B正确;18 8 |


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、240mL,4.4g |
| B、250mL,4.4g |
| C、250mL,5.0g |
| D、240mL,5.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 |
| B、1010:1 |
| C、109:1 |
| D、108:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中性溶液就是PH=7的溶液 |
| B、中性溶液是指c(H+)=c(OH-)的溶液 |
| C、酸与碱恰好完全中和所得的溶液是中性溶液 |
| D、不能使酸碱指示剂显色的溶液是中性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol/L的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
如图是实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol/L的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
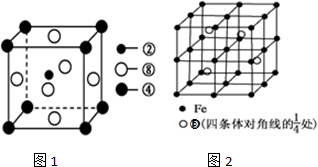
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com