
 常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LKOH溶液.整个实验过程溶液中c(OH-)的变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LKOH溶液.整个实验过程溶液中c(OH-)的变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是( )| A. | a点对应溶液中含有的分子有H2O、HClO、HCl、Cl2 | |
| B. | b点对应溶液中:c(H+)>c(Cl-)>c(HClO)>c(ClO-)>c(OH-) | |
| C. | c点对应溶液中:c(K+)=c(Cl-)+c(ClO-)+c(HClO) | |
| D. | 实验过程中可以用pH试纸测定溶液的pH |
分析 整个过程先后发生的反应为Cl2+H2O═HCl+HClO、HCl+KOH═KCl+H2O、HClO+KOH═KClO+H2O,
A、盐酸是强电解质完全电离;
B、b点所示溶液中发生反应:Cl2+H2O=H++Cl-+HClO,HClO为弱电解质,部分电离,结合电荷守恒判断;
C、c点呈中性,则c(H+)=c(OH-),根据电荷守恒、物料守恒判断;
D、溶液中含有次氯酸,具有漂白性,不能用pH试纸测pH;
解答 解:A、盐酸是强电解质完全电离,所以a点对应溶液中含有的分子有H2O、HClO、Cl2,故A错误;
B、b点所示溶液中发生反应:Cl2+H2O=H++Cl-+HClO,HClO为弱电解质,部分电离,溶液中存在的粒子有:H+、Cl-、ClO-、OH-,H2O、HClO、Cl2,溶液中:c(H+)>c(Cl-)>c(HClO)>c(ClO-)>c(OH-),故B正确;
C、c点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(K+)=c(Cl-)+c(Cl0-)+c(OH-),所以c(K+)=c(Cl-)+c(ClO-),根据物料守恒得c(Cl-)=c(ClO-)+c(HClO),所以c(K+)=c(HClO)+2c(ClO-),故C错误;
D、溶液中含有次氯酸,具有漂白性,不能用pH试纸测pH,应选pH计,故D错误;
故选B.
点评 本题考查了离子浓度大小的判断,题目难度中等,明确溶液中的溶质及其性质是解本题关键,注意电荷守恒、物料守恒及盐的水解原理的应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 催化剂可以加快化学反应速率,也能增大化学反应的焓变 | |
| B. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| C. | 25℃下,在NH3•H2O稀溶液中加水稀释,$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值不变 | |
| D. | 在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-电离程度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
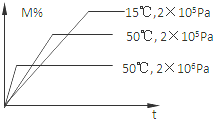 在密闭容器中进行反应:M(g)+N(g)?R(g)+2L,此反应符合下图关系,该反应是下列哪种情况( )
在密闭容器中进行反应:M(g)+N(g)?R(g)+2L,此反应符合下图关系,该反应是下列哪种情况( )| A. | 正反应吸热,L是固体或液体 | B. | 正反应吸热,L是气体 | ||
| C. | 正反应放热,L是固体或液体 | D. | 正反应放热,L是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每一个反应,在一个温度下,有一个K值 | |
| B. | K越大,表示正向反应的倾向大,反应完全 | |
| C. | K值只能说明反应的最大限度,不能说明反应的速度 | |
| D. | 吸热反应的K值大于所有放热反应的K值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中钢铁制品生锈主要是由于吸氧腐蚀所致 | |
| B. | 乙烯可作为水果的催熟剂 | |
| C. | 葡萄糖、油脂、蛋白质等进入人体内经水解后被吸收 | |
| D. | 使用漂白液时不可与酸性洁厕剂混用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用合适的催化剂可大大提高生产效率 | |
| B. | 由反应需在300℃进行,可知该反应是吸热反应 | |
| C. | 增大原料气中CO2的百分含量,可以提高H2的转化率 | |
| D. | 70MPa的压力,不仅可以增加单位时间内的产出,还可以提高CO2和H2的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
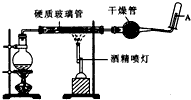 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸或稀硫酸, 在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立, 溶液变成红色,则假设一不成立 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com