
【题目】常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。已知d点所示的溶液中,钠元素与氯元素的物质的量相等,下列选项正确的是( )

A.a点时,已经滴入NaOH溶液
B.b点所示的溶液中,只存在两种分子
C.a、b、c、d四个点当中,d点水的电离程度最大
D.c点所示的溶液中,c(Na+)=c(Cl-)+c(HClO)
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2L的恒容密闭容器中按不同方式投入反应物,发生反应:2CO(g) + 4H2(g)CH3OCH3(g) + H2O(g) △H<0,测得反应的相关数据如下表:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 600 | 600 | 500 |
反应物投入量 | 0.2mol CO 0.4mol H2 | 0.4mol CO 0.8mol H2 | 0.2mol CH3OCH3 0.2mol H2O |
平衡v(CO)/(mol·L-1·s-1) | v1 | v2 | v3 |
平衡n(H2)/(mol) | 0.2 | n2 | n3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | a1(CO) | a2(CO) | a3(CH3OCH3) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A.v1<v2,n2>0.4B.K2=2.5×103,p2>p3
C.2p1<p3,a1(CO) >a2(CO)D.n3<0.4,a2(CO) + a3(CH3OCH3)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,不正确的是

A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
B.放电时,Li+透过固体电解质向Cu极移动
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积为2L的密闭容器中,将2 mol 气体M和3 mol N气体混合,发生如下反应:2M(g)+3N(g)![]() xQ(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
xQ(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
A. x值为2 B. 混合气体的密度增大
C. N的转化率为80% D. 混合气体平均摩尔质量不变,不能说明该反应达平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有质量比为11:14的CO2和CO的混合气体,则该混合气体中的CO2和CO物质的量之比为________,碳原子和氧原子的个数比为________,该混合气体的摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K2Cr2O7溶液中存在平衡:![]() +H2O
+H2O![]() 2
2![]() +2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
5mL0.1mol/LK2Cr2O7溶液 | 序号 | 试剂X |
ⅰ | 1mL1mol·L-1 K2Cr2O7 溶液 | |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | |
ⅲ | 5~15滴浓硫酸 | |
ⅳ | 5~15滴浓盐酸 | |
ⅴ | 5~15滴6 mol·L-1 NaOH溶液 |
Ⅰ.方案讨论
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是_____(填序号)。
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将_____。(填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
序号 | 试剂X | 预期现象 | 实际现象 |
ⅰ | 1 mL1 mol·L-1 K2Cr2O7 溶液 | 溶液变黄 | 溶液橙色加深 |
ⅱ | 1mL1 mol·L-1 K2CrO | 溶液橙色加深 | 溶液颜色变浅 |
ⅲ | 5~15滴浓硫酸 | 溶液橙色加深 | 溶液橙色加深 |
ⅳ | 5~15滴浓盐酸 | 溶液橙色加深 | 无明显现象 |
ⅴ | 5~15滴6mol·L-1NaOH溶液 | 溶液变黄 | 溶液变黄 |
(1)实验ⅰ没有观察到预期现象的原因是_____,实验ⅱ的原因与其相似。
(2)通过实验ⅲ和ⅴ得出的结论为_____。
(3)实验ⅳ无明显现象,可能的原因是____________。
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了下实验,验证了该反应的发生。
方案:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从![]() 甲烷
甲烷![]() 甲醛
甲醛![]() 乙酸
乙酸![]() 油脂
油脂![]() 纤维素
纤维素![]() 聚乙烯六种有机物中选择合适的物质,将其标号添在横线上.
聚乙烯六种有机物中选择合适的物质,将其标号添在横线上.
![]() 瓦斯的主要成分是 ______ ;
瓦斯的主要成分是 ______ ;
![]() 可制成食品保鲜膜和保鲜袋的 ______ ;
可制成食品保鲜膜和保鲜袋的 ______ ;
![]() 食醋可做增强食品酸味的调味剂,是因为其中含有 ______ ;
食醋可做增强食品酸味的调味剂,是因为其中含有 ______ ;
![]() 福尔马林溶液可以作为保存动物标本的溶液,是因为其中含有
福尔马林溶液可以作为保存动物标本的溶液,是因为其中含有![]() 的 ______ ;
的 ______ ;
![]() 可用来制造肥皂的原料的是 ______ ;
可用来制造肥皂的原料的是 ______ ;
![]() 纯棉的衣服的化学成分是 ______ .
纯棉的衣服的化学成分是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
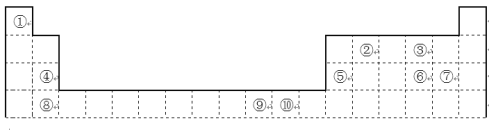
请回答下列问题:
(1)表中属于ds区的元素是(填编号)____________。
(2)元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨.有关该化合物分子的说法正确的是______。
A.分子中含极性共价键 B.含有1个σ键和2个π键 C.属于非极性分子 D.该化合物分子中,②原子采用sp2杂化
(3)根据上述表格中的十种元素填空:
I.金属性最强的主族元素是_______(填元素名称);
II.⑤、⑥、⑦的离子半径由小到大的顺序是_____(填化学式);
III.⑥、⑦两种元素的最高价氧化物对应的水化物的酸性由大到小的顺序是____(填化学式)。
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为_;该元素与元素①形成的分子X的空间构型为_。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com