
【题目】实验室收集①一氧化氮、②二氧化氮两种气体,下列收集方法正确的是( )
A. ①和②都用排水法
B. ①和②都用向上排空气法
C. ①用向上排空气法,②用排水法
D. ①用排水法,②向上排空气法
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO ![]() 、SO
、SO ![]() 、Cl﹣、CO
、Cl﹣、CO ![]() 的某一种(1)若将四种盐分别溶于中水中,只有C盐溶液显蓝色.(2)若向四种溶液中分别加盐酸,B盐溶液中沉淀生成,D盐溶液中有无色无味的气体生成.根据以上事实,可推断:
的某一种(1)若将四种盐分别溶于中水中,只有C盐溶液显蓝色.(2)若向四种溶液中分别加盐酸,B盐溶液中沉淀生成,D盐溶液中有无色无味的气体生成.根据以上事实,可推断:
(1)A、B、C、D的化学式分别为:A、B、C、D、
(2)分别写出下列反应的离子方程式:A+DD与盐酸: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极电解某金属的硫酸盐(XSO4)溶液,当阳极上收集到1.12L气体(标准状况,忽略气体溶解)时,阴极质量增加6.4g,下列判断不正确的是( )
A. 电路中有0.1mol电子通过
B. 该金属是Cu
C. 电解后溶液的pH降低
D. 向电解后的溶液中加入0.1molCuO可使溶液恢复电解前的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:【实验一】焦亚硫酸钠的制取
采用如图1装置(实验前已除尽装置内的空气)制取Na2S2O5 . 装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2═Na2S2O5 . 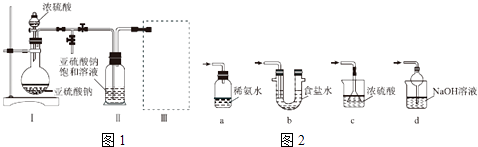
(1)装置Ⅰ中产生气体的化学方程式为 .
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 .
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为(填序号).
(4)【实验二】焦亚硫酸钠的性质:Na2S2O5溶于水即生成NaHSO3 . 证明NaHSO3溶液中HSO ![]() 的电离程度大于水解程度,可采用的实验方法是(填序号).
的电离程度大于水解程度,可采用的实验方法是(填序号).
a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检测Na2S2O5晶体在空气中已被氧化的实验方案是
(6)【实验三】葡萄酒中抗氧化剂残留量的测定葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:![]()
(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为gL﹣1 .
②在上述实验过程中,若有部分HI被空气氧化,则测定结果(填“偏高”“偏低”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化铜(Ⅱ)甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
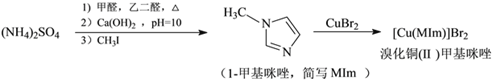
(1)铜元素位于周期表中第___族___区,基态Cu2+的核外电子排布式为______________。
(2)与NH4+互为等电子体的阴离子为__________________。
(3)MIm中碳原子杂化轨道类型为____________;1molMIm中含![]() 键数目为________ mol。
键数目为________ mol。
(4)一种铜的溴化物晶胞结构如图所示。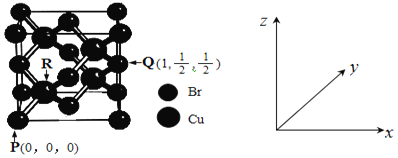
有关说法正确的是____________(填序号)。
a.该化合物的化学式为CuBr2 b.铜的配位数为8
c.与每个Br紧邻的Br有12个
d.由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为(![]() ,
,![]() ,
,![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:

回答下列问题:
(1)基态钛原子的价电子排布图为___________________,其原子核外共有_____种运动状态不相同的电子。金属钛晶胞如下图2所示,为________________堆积(填堆积方式)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l-l >> l-b > b-b(l为孤对电子对,b为键合电子对),则关于H2O中的H-O-H键角可得出的结论是________。
A.180° B.接近120°,但小于120°
C.接近120°,但大于120° D.接近109°28’,但小于109°28’
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃,可知TiCl4为______晶体。
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图1。化合物乙的沸点明显高于化合物甲,主要原因是___________________________。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为__________________。

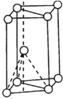
图1 图2
(5)钙钛矿晶体的结构如右图所示。钛离子位于立方晶胞的角顶,被_______个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被__________个氧离子包围。钙钛矿晶体的化学式为_______。若该晶胞的边长为a pm,则钙钛矿晶体的密度为______________g.cm-3(只要求列算式,不必计算出数值)。
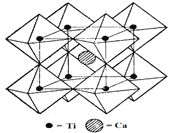
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N的质量数为14,在粒子NH3T+中,电子数、质子数、中子数之比为
A. 10∶7∶11B. 10∶11∶8C. 10∶11∶9D. 11∶9∶10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________________________。
(2)烧杯间填满碎纸条的作用是________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏大、偏小、无影响”)
(4)如果用50mL0.50mol/L硝酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________________(填“相等、不相等”),所求中和热__________(填“相等、不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列 有关R,W,X,Y,Z 5种元素的叙述中,正确的是( ) 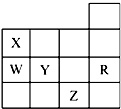
A.常压下5种元素的单质中Z单质的沸 点最高
B.Y,Z的阴离子电子层结构都与R原子的相同
C.Y元素的非金属性比W元素的非金属性强
D.W的氢化物的还原性比Y的氢化物的还原性弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com