
| A. | 反应前后气体的压强之比为2:1 | |
| B. | 反应前后气体的密度之比为15:16 | |
| C. | 此时CO的转化率为50% | |
| D. | 如果反应继续向正向进行,气体的平均相对分子质量将减小 |
分析 设初始时加入H2、CO 分别为xmol、ymol,则由平均相对分子质量为15,所以$\frac{2x+28y}{x+y}$=15,解得x:y=1:1;可令设初始时加入H2、CO 都为1mol;
H2(g)+CO(g)=C(s)+H2O(g).
初起的物质的量:1mol 1mol 0 0
变化的物质的量:z z z z
平衡时物质的量:1-z 1-z z z
由题意可知:$\frac{(1-z)×2+28×(1-z)+18z}{2-z}$=16
解得z=0.5mol,据此分析解答.
解答 解:A、根据以上分析,反应前后气体的压强之比为2:(2-0.5)=3:2,故A错误;
B、因为恒温恒容的容器中,所以反应前后气体的密度之比即为气体质量之比,所以为(2×1+28×1):(2×0.5+28×0.5+18×0.5)=5:4,故B错误;
C、根据以上分析,CO的转化率为$\frac{0.5}{1}$×100%=50%,故C正确;
D、如果反应继续向正向进行,则生成更多的水蒸气,所以气体的平均相对分子质量将增大,故D错误;
故选:C.
点评 本题考查了化学平衡的相关判断及其计算,注意利用三组量法计算计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
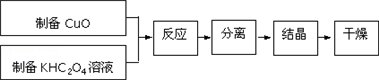
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物总能量为679kj | |
| B. | 生成物总能量为431kj | |
| C. | 氢气和氯气反应生成2mol氯化氢气体,反应放出183kJ能量 | |
| D. | 氢气和氯气反应生成2mol氯化氢气体,反应吸收183kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的分子式:CH3CH2OH | B. | 次氯酸的电子式: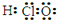 | ||
| C. | NH4Cl的电子式: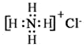 | D. | 乙醛结构简式:CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲的分子数比乙的分子数多 | |
| B. | 甲的物质的量比乙的物质的量小 | |
| C. | 气体摩尔体积:甲<乙 | |
| D. | 甲的相对分子质量比乙的相对分子质量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 578 | 1817 | 2745 | 11575 | 14830 | 18376 | 23293 |
| A. | ⅠA | B. | ⅡA | C. | ⅢA | D. | ⅣA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
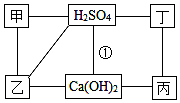 如图中的每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种.
如图中的每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:HI(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5 kJ•mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量 | |
| B. | 已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则氢气的燃烧热△H=-571.6 kJ•mol-1 | |
| C. | 肼(N2H4)是一种用于火箭或燃料电池的原料,已知2H2O(g)+O2(g)═2H2O2(l)△H1=+108.3 kJ•mol-1 ① N2H4(l)+O2(g)═N2(g)+2H2O(g)△H2=-534.0 kJ•mol-1 ② 则有反应:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-642.3 kJ•mol-1 | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com