
【题目】在一定温度下,将0.2mol的碘化氢充入1L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.08mol/L.
(1)求该反应的平衡常数.
(2)在上述温度下,该容器中若充入碘化氢0.4mol,求达到平衡时碘化氢的转化率和氢气的物质的量浓度.
【答案】
(1)解:达到平衡时,测得c(H2)=0.08mol/L,则
2HI(g) | H2(g)+ | I2(g) | ||
起始时各物质的浓度(molL﹣1) | 0.2 | 0 | 0 | |
各物质的浓度变化量(molL﹣1) | 0.16 | 0.08 | 0.08 | |
平衡时各物质的浓度(molL﹣1) | 0.04 | 0.08 | 0.08 |
平衡时c(H2)=c(I2)=0.08mol/L,c(HI)=0.04mol/L,
则K= ![]() =4,
=4,
答:该反应的平衡常数为4
(2)解:在上述温度下,该容器中若充入碘化氢0.4mol,设HI转化了x;则
2HI(g) | H2(g)+ | I2(g) | ||
起始时各物质的浓度(molL﹣1) | 0.4 | 0 | 0 | |
各物质的浓度变化量(molL﹣1) | x | 0.5x | 0.5x | |
平衡时各物质的浓度(molL﹣1) | 0.4﹣x | 0.5x | 0.5x |
K= ![]() =4,
=4,
解得:x=0.32 mol;
碘化氢转化率= ![]() ×100%=80%
×100%=80%
所以平衡时c(H2)= ![]() =0.16mol/L;
=0.16mol/L;
答:平衡时碘化氢的转化率为80%,氢气的物质的量浓度为0.16mol/L
【解析】(1)达到平衡时,测得c(H2)=0.08mol/L,则
2HI(g) | H2(g)+ | I2(g) | ||
起始时各物质的浓度(molL﹣1) | 0.2 | 0 | 0 | |
各物质的浓度变化量(molL﹣1) | 0.16 | 0.08 | 0.08 | |
平衡时各物质的浓度(molL﹣1) | 0.04 | 0.08 | 0.08 |
利用平衡的浓度计算K,K为生成物浓度幂之积与反应物浓度幂之积的比;(2)设转化的碘化氢为x,利用三段法得出各物质的平衡浓度,平衡常数与(1)相同,以此来计算.
【考点精析】关于本题考查的化学平衡的计算,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。

(1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_____。
a.SO2 b.NOx c.VOCs d. NH3
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______。

(3)SO2是气体污染物的主要成分之一。作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2不同类的化学性质,将化学方程式填在下表中。
SO2性质梳理 | 化学方程式 | |
物质类别 | 酸性氧化物 | ①SO2+H2O |
②SO2+CaO=CaSO3 | ||
③_______ | ||
S元素价态 | S为+4价 | ①_______ |
②SO2 +2H2S=3S+2H2O | ||
(4)科学家经过研究发现中国霾呈中性,其主要原因如下图所示:
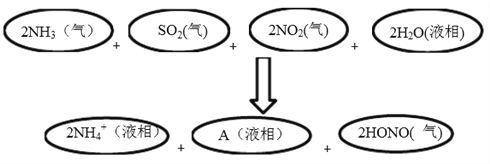
请判断A的化学式并说明判断理由:______________________。
(5)煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计):
离子 | Na+ | SO42 | NO3 | H+ | Cl |
浓度/(mol·L1) | 5.5×103 | 8.5×104 | y | 2.0×104 | 3.4×103 |
①SO2和NaClO2溶液反应的离子方程式是_________________。
②表中y =______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是中学化学的常见物质,它们在一定条件下有如下转化关系:A ![]() B
B ![]() C
C
(1)若A为能使湿润的红色石蕊试纸变蓝的气体,C为红棕色气体.则A的空间构型为 , A转化为B反应的化学方程式为 .
(2)若A、B、C均为氧化物,A为砖红色固体,且A中金属元素为+1价,D是一种黑色固态非金属单质,则A的化学式为 , B的电子式为 .
(3)若D为氯碱工业的主要产品,B为高中常见的一种具有两性的物质,则C溶液中除氢氧根外还存在的阴离子的化学式为 . 氯碱工业中阴极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答下列问题:
(1)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4 =2ClO2↑+O2↑+2Na2SO4+2H2O
①方法一的离子方程式为____________________________________.
②方法二中被氧化的物质是___________,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为___________L,在下面的化学方程式上用双线桥标出电子转移的方向和数目
2NaClO3+H2O2+H2SO4 =2ClO2↑+O2↑+2Na2SO4+2H2O___________
③某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3- 的浓度之比为1:1,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为____________;
(2)现用98%的浓H2SO4(密度为1.84g/cm3)来配制480mL 0.2mol/L的稀H2SO4。
有关操作为:①计算所需浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释、冷却 ④转移、洗涤 ⑤定容 ⑥摇匀。回答下列问题
①应量取的浓硫酸体积是__________,实验中所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外还有_________________;
②将所配制的稀H2SO4进行测定,发现实际浓度大于0.2mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母)_________________________。
A. 用量筒量取浓硫酸时,仰视量筒的刻度
B. 容量瓶未干燥即用来配制溶液
C. 浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D. 往容量瓶转移时,有少量液体溅出
E. 烧杯未进行洗涤
F. 在容量瓶中定容时俯视容量瓶刻度线
G. 定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在图所示物质的转化关系中,D在常温下为无色无味的液体(反应条件均已省略).请回答下列问题:
(1)高温下发生的反应②中,若F为常见的金属单质,H是非金属单质,用化学方程式表示G的一个重要用途: .
(2)若F为淡黄色粉末,①写出反应②的化学方程式并用双线桥标出电子转移的方向和数目 .
②F的电子式 .
(3)若A是一种强酸,B是一含有两种金属元素的盐,且其水溶液显碱性,写出①反应的离子方程式 .
(4)若A、F、H是短周期且相邻的两个族的元素单质,且反应均在溶液中进行,请写出:①的离子方程式;
②的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数(NA)的说法错误的是( )
A. 32g O2所含的原子数目为NA
B. 0.5mol H2O含有的原子数目为1.5NA
C. 1mol H2O含有的H2O分子数目为NA
D. 0.5NA个氯气分子的物质的量是0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,说明氨有还原性和碱性的是( )
A.2NH3+3CuO ![]() 3Cu+N2↑+3H2O
3Cu+N2↑+3H2O
B.8NH3+3Cl2═6NH4Cl+N2
C.4NH3+6NO ![]() 5N2+6H2O
5N2+6H2O
D.NH3+HCl═NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
A.2 mol·L-1 H2SO4溶液
B.18 mol·L-1 H2SO4溶液
C.6 mol·L-1 KOH溶液
D.3 mol·L-1 HNO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com