


| 1 |
| 3 |
| 1000ml |
| 25ml |


科目:高中化学 来源: 题型:
A、CO2的电子式:
| ||||||||||||
B、Cl-的结构示意图 | ||||||||||||
| C、甲烷的结构式 CH4 | ||||||||||||
D、质量数为37的氯原子
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用蒸发结晶法除去KNO3中少量的NaCl |
| B、用加入NaOH(aq)并蒸馏的方法除去乙醛中少量的乙酸 |
| C、准确称取14.800g Ca(OH)2,配制100mL 2.0 mol/L的Ca(OH)2溶液 |
| D、在2mL10%的CuSO4(aq)中滴入3滴 2%的NaOH(aq),配制检验醛基的试剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8.00 | B、7.92 |
| C、7.90 | D、7.86 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ |
| C、②③④ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2
结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2| 酸性高锰酸钾溶液 |
 )为原料合成环状化合物F和高分子化合物E和G.
)为原料合成环状化合物F和高分子化合物E和G.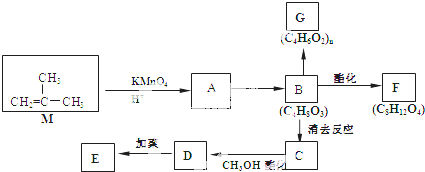
查看答案和解析>>
科目:高中化学 来源: 题型:
 某稀硫酸和硝酸的混合溶液200mL,分成两份.向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO).向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示.
某稀硫酸和硝酸的混合溶液200mL,分成两份.向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO).向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com