
分析 (1)平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$;根据氨气的浓度计算氮气浓度变化量,起始浓度=平衡浓度+浓度变化量;
(2)转化率=$\frac{浓度变化量}{起始浓度}$×100%;
(3)平衡后要提高H2的转化率,用改变条件使平衡正向移动,但不能只增大氢气浓度,结合平衡移动原理分析.
解答 解:(1)平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{{4}^{2}}{3×{9}^{3}}$=$\frac{16}{2187}$,△c(N2)=$\frac{1}{2}$△c(NH3)=$\frac{1}{2}$×4mol•L-1=2mol•L-1,则起始浓度c(N2)=3mol•L-1+2mol•L-1=5mol•L-1,
故答案为:$\frac{16}{2187}$;5mol•L-1;
(2)由方程式可知,△c(H2)=$\frac{3}{2}$△c(NH3)=$\frac{3}{2}$×4mol•L-1=6mol•L-1,氢气转化率=$\frac{6mol/L}{9mol/L+6mol/L}$×100%=40%,
故答案为:40%;
(3)a.合成氨是放热反应,升高温度平衡逆向移动,不利于氨气生成,氢气转化率减小,故a错误;
b.加入催化剂,加快反应速率,不影响平衡移动,氢气转化率不变,故b错误;
c.增加N2的浓度,平衡正向移动,氢气转化率增大,故c正确;
d.增加H2的浓度,虽然平衡正向移动,但氢气转化率减小,故d错误;
e.分离出NH3,平衡正向移动,氢气转化率增大,故e正确,
故选:ce.
点评 本题考查化学平衡计算与影响因素、化学平衡常数等,比较基础,旨在考查学生对基础知识的掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
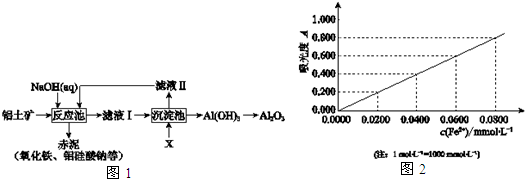
 n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).
n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: I:C(s)+H2O(g)?CO(g)+H2(g) K1 II:CO(g)+H2O(g)?CO2(g)+H2(g) K2 III:CaO(s)+CO2(g)?CaCO3(s) K3 | 通入纯氧,主要化学反应: IV:C(s)+O2(g)=CO2(g)△H=-393.8kJ•mol-1 V:CaCO3(s)=CaO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动 | B. | 气体C的体积分数增大 | ||
| C. | m+n>p | D. | 气体A的转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中加入铁粉:Fe3++Fe=2Fe2+ | |
| B. | 将NH3通入H2SO4溶液中:NH3+H+=NH4+ | |
| C. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| D. | H2SO4溶液与Ba(OH)2溶液混合:H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2都是直线形分子 | |
| B. | H2O和NH3的VSEPR模型不同 | |
| C. | 由分子构成的物质中一定含有共价键 | |
| D. | 形成共价键的元素不一定是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64g Cu粉与足量硫粉加热完全反应生成Cu2S时失去的电子数为2NA | |
| B. | 足量的CO2与39gNa2O2发生反应转移的电子数为NA | |
| C. | 18g的D2O与NA个-CH3具有相同的电子数 | |
| D. | 6.0g醋酸晶体中含有H+的数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com