
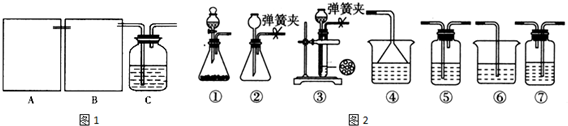
分析 (1)制CO2时为了使反应随开随用,随关随停,需要应用启普发生器的装置原理,利用止水夹控制气体压强,使液体和固体分离停止反应,打开压强减小液体和固体接触继续反应;
(2)制备出二氧化碳气体中含有氯化氢气体,影响碳酸氢钠的生成,B装置中需要通过饱和碳酸氢钠溶液除去;则B装置为洗气装置;
(3)降低反应的温度,碳酸氢钠溶解度减小;
(4)依据化学方程式计算理论生成碳酸氢钠的质量,依据碳酸氢钠分解的化学方程式计算碳酸钠质量,结合实际生成碳酸钠的质量计算产率.
解答 解:(1)启普发生器是随时进行,随时停止的装置,适用于固体和液体不加热反应生成不溶于水的气体制备反应,所以制CO2时为了使反应随开随用,随关随停应符合启普发生器的原理应用,应该选用装置③,利用止水夹控制气体压强,关闭弹簧夹后反应生成的气体使上部压强增大,到达一定程度后可把反应液压回漏斗,使液体和固体分离停止反应,打开压强减小液体和固体接触继续反应;
故答案为:③;关闭弹簧夹后反应生成的气体使上部压强增大,到达一定程度后可把反应液压回漏斗,使固液分离从而停止反应;
(2)制备出二氧化碳气体中含有氯化氢气体,影响碳酸氢钠的生成,B装置中需要通过饱和碳酸氢钠溶液除去;则B装置洗气装置,导气管长进短出,所以选择图中的装置⑤;
故答案为:⑤;饱和碳酸氢钠溶液;
(3)通过降低温度,减小碳酸氢钠的溶解度,使碳酸氢钠析出,所以将C装置浸泡在一个盛有冰水混合物的水槽里(大烧杯)可以达到目的;
故答案为:将C装置浸泡在一个盛有冰水混合物的水槽里(或大烧杯中);
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,理论上依据化学方程式计算:NH3+CO2+H2O+NaCl=NaHCO3+NH4Cl;得到碳酸氢钠质量为8.4g,分解生成碳酸钠质量依据化学方程式计算:2NaHCO3=Na2CO3+H2O+CO2↑;碳酸钠的质量为5.3g;实验后得到干燥的NaHCO3晶体的质量为5.46g,生成碳酸钠质量为:
2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
168 106
5.46g 3.445g
假设第二步分解时没有损失,则碳酸钠的产率=$\frac{3.445g}{5.3g}$×100%=65%;
故答案为:65%.
点评 本题考查了纯碱制备原理的实验应用,此题是一道实验探究综合题,该题综合性强,侧重于考查学生对基础知识的综合应用能力和实验探究能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1mol/LNa2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-)>c(H+) | |
| C. | pH相同的①CH3 COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
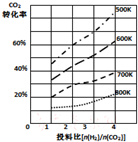 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂 | 提纯方法 |
| A | BaSO4 | BaCO3 | 水 | 溶解、过滤、洗涤 |
| B | CO2 | SO2 | 饱和 Na2CO3 溶液 | 洗气 |
| C | 乙烷 | 乙烯 | 酸性 KMnO4 溶液 | 洗气 |
| D | 蛋白质 | 葡萄糖 | 浓 (NH4)2SO4 溶液 | 盐析、过滤、洗涤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
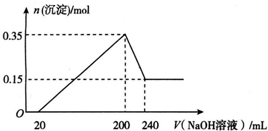 将一定质量的镁和铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示.则下列说法错误的是( )
将一定质量的镁和铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示.则下列说法错误的是( )| A. | 镁和铝的总质量为9 g | |
| B. | 最初20 mL NaOH溶液用于中和过量的稀硫酸 | |
| C. | 氢氧化钠溶液的物质的量浓度为5 mol•L-1 | |
| D. | 生成的氢气在标准状况下的体积为11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色 | |
| B. | 能使品红溶液褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | SO2和Cl2等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
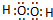 ,W第一步电离方程式为H2O2?H++HO2-.
,W第一步电离方程式为H2O2?H++HO2-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com