
【题目】在下图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。下表中所列出的 a、b物质不符合要求的是
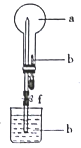
a(干燥气体) | b(液体) | |
A | NO2 | 水 |
B | SO2 | 饱和酸性高锰酸钾溶液 |
C | Cl2 | 饱和NaOH馆液 |
D | NH3 | 2 mol/L.盐酸 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
元索 | 相关信息 |
T | T元素可形成自然界硬度最大的单质 |
W | W与T同周期,核外有一个未成对电子 |
X | X原子的第一离能至第四电离能分别I1=578 kJ/mol; I2= l817 kJ/mol; I3=2745 kJ/mol;I4=11575kJ/mol |
Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
Z | Z的一种同位素的质量数为63,中子数为34 |
(1)TY2的结构式是__________是__________(填“极性分子”或“非极性分子”),1mol该分子中存在________个σ键。

(2)基态Y原子中,电子占据的最高能层符号为__________,该能层具有的原子轨道数为_____________、电子数为_________。Y、氧、W元素的电负性由大到小的顺序为_________(用元素符号作答)。
(3)已知Z的晶胞结构如图所示,又知Z的密度为a g/cm3,则Z 的半径为___________pm;ZYO4常作电镀液,其中YO42-的等电子体是__________,其中Y原子的杂化轨道类型是___________。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z +HCl+O2=ZC1+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是___________。
A.O2是氧化剂 B.HO2是氧化产物
C.HO2在碱中能稳定存在 D.1 mol Z参加反应有1 mol电子发生转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯化碘(沸点97.4℃)是一种红棕色易挥发的液体,不溶于水,溶于乙醇和乙酸。某校研究性学习小组的同学拟制备一氯化碘。回答下列问题:
(1)甲组同学拟利用干燥、纯净的氯气与碘反应制备一氯化碘,其装置如下:(已知碘与氯气的反应为放热反应)
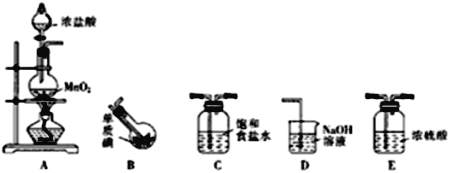
①各装置连接顺序为A→_________________;A装置中发生反应的离子方程式为_____________________________。
②B装置烧瓶需放在冷水中,其目的是_____________________,D装置的作用是_________________。
③将B装置得到的液态产物进一提纯可得到较纯净的ICl,则提纯采取的操作方法是______________。
(2)乙组同学采用的是最新报道的制一氯化碘的方法。即在三颈烧瓶中加入粗碘和盐酸,控制温度约50℃,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘。则发生反应的化学方程式为_______________________________。
(3)设计实验证明:
①ICl的氧化性比I2强:__________________________。
②ICl与乙烯作用发生加成反应:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铜片插入硝酸银溶液中? Cu+Ag+=Cu2++Ag
B.碳酸钙与盐酸反应:CO32﹣+2H+═CO2↑+H2O
C.硫酸铜溶液与氢氧化钡溶液反应:Ba2++ ![]() ═BaSO4↓
═BaSO4↓
D.铁与稀硫酸反应:Fe+2H+═Fe2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下0.1mol/L CH3COOH溶液中c(H+)=1.32×10-3mol/L,则该CH3COOH溶液中的水的离子积常数Kw是
A.1×10-14B.1×10-13C.1.32×10-14D.1.32×10-15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )

A.OE段表示的平均速率最快
B.EF段,用盐酸表示该反应的平均反应速率为0.4 mol·L-1·min-1
C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
D.F点收集到的CO2的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:H2(g)+ Cl2(g) ═ 2HCl(g) △H=-184.6 kJmol-1则反应HCl(g) ═1/2 H2(g) +1/2 Cl2(g)的△H为_______。
(2)由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是_______kJ/mol。
(3)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH= x kJ·mol-1
已知碳的燃烧热ΔH1= a kJ·mol-1
S(s)+2K(s)==K2S(s) ΔH2= b kJ·mol-1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3= c kJ·mol-1 则x为_______kJ/mol
(4)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某溶液中Ca2+的含量,某冋学设计了如下实验:量取100 mL该溶液于烧杯中,加入足量的(NH4)2C2O4溶液使Ca2+转化为CaC2O4沉淀(假设其他离子均不生成沉淀),过滤、洗涤后,往沉淀中加入足量稀硫酸,然后用0.1000molL-1的KMnO4标准溶液滴定。
(1)配平KMnO4氧化H2C2O4的化学方程式:____________________
(2)如图所示的仪器中,配制0.1000molL-1的KMnO4标准溶液时肯定不需要的是___(填标号),除此之外还需用到的玻璃仪器是___(填仪器名称)。

(3)在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.1000molL-1(填“>”、“<”或“=”,下同);若KMnO4标准溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度___0.1000molL-1。
(4)若滴定过程中消耗KMnO4标准溶液20.00mL,则原溶液中Ca2+的质量浓度为___gL-1。
(5)下图为草酸钙固体在受热分解过程中所得固体产物的质量随温度变化的曲线,图中A、B、C分别代表三种固体,写出固体A到B的化学方程式:_________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com