
| A、②③④⑤ | B、②③④ |
| C、②⑤ | D、①②③④⑤ |


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、④①②⑤③ |
| B、④①②⑤③ |
| C、①④⑤③② |
| D、①④②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol锌粒与足量盐酸反应产生11.2 L H2 |
| B、标准状况下,11.2 L CCl4所含分子数为0.5NA |
| C、0.1 mol CH4所含氢原子数为0.4NA |
| D、常温常压下,28 g N2中所含原子个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烧碱固体在水中溶解的过程是放热反应 |
| B、P2O5和CaO可以作干燥剂,利用了它们具有易潮解的性质 |
| C、FeCl3固体溶于蒸馏水可制得FeCl3溶液 |
| D、粗盐易潮解是因为其中含有CaCl2和MgCl2等杂质的缘故 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1mol甲基(-CH30)所含的电子数为9NA |
| B、质子总数为5NA的重水(D2O)物质的量是0.5mol |
| C、0.1molK2O2与水反应时,转移的电子数为0.2NA |
| D、常温常压下,NA个甲烷分子的体积大于22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| A、①③为置换反应 |
| B、①②③均为氧化还原反应 |
| C、②为化合反应 |
| D、三个反应的反应物中硅元素均被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
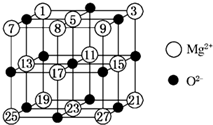 镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.
镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com