
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O 100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| A. | 系列①的(a)物质中没有离子键,应有共价键和分子间作用力 | |
| B. | 系列③中(c)物质的沸点比HCl高是因为(c)中的共价键更牢固 | |
| C. | 系列②中(b)物质的元素的原子序数应为35,且该物质常温下为液态 | |
| D. | 系列④中H2O沸点变化出现反常,是因为分子内有氢键的影响 |
分析 A.稀有气体是单原子分子,稀有气体中只含分子间作用力不含化学键;
B.氢化物都是分子晶体,分子晶体熔沸点与相对分子质量成正比,但含有氢键的熔沸点较高;
C.卤族单质都是分子晶体,分子晶体熔沸点与相对分子质量成正比,其单质的熔沸点随着原子序数增大而增大,溴常温下为液态;
D.水中分子间有氢键.
解答 解:A.分子晶体熔沸点较低,根据该组物质熔沸点知,都是分子晶体,所以没有离子键,稀有气体是单原子分子,稀有气体中只含分子间作用力不含化学键,故A错误;
B.氢化物都是分子晶体,分子晶体熔沸点与相对分子质量成正比,但含有氢键的熔沸点较高,③中(c)物质是HF,HF中含有氢键导致其熔沸点最大,故B错误;
C.卤族单质都是分子晶体,分子晶体熔沸点与相对分子质量成正比,其单质的熔沸点随着原子序数增大而增大,根据熔沸点知②中(b)物质为Br2,溴常温下为液态,Br的相对原子质量为35,故C正确;
D.水中分子间有氢键,分子内没有氢键,故D错误;
故选C.
点评 本题考查晶体熔沸点高低判断,为高频考点,侧重考查学生分析判断及总结归纳能力,注意化学键影响物质的稳定性,分子间作用力及氢键影响物质熔沸点,为易错点.


科目:高中化学 来源: 题型:解答题
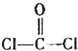 的空间结构为平面三角形.
的空间结构为平面三角形.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molSiO2含有2NA个Si-O键 | |
| B. | 1molNa2O2固体中含离子总数为3NA. | |
| C. | 标准状况下,22.4 L SO3所含分子数为NA. | |
| D. | 1L0.5mol/L的MgCl2溶液中,含有Mg2+个数为0.5NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙醇和乙酸都能发生取代反应,油脂不能 | |
| B. | “地沟油”主要成分为油脂,可回收制取生物柴油 | |
| C. | 蛋白质、糖类、油脂都属于人体必需的高分子化合物 | |
| D. | 脂肪、蛋白质、聚氯乙烯充分燃烧均只生成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
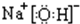
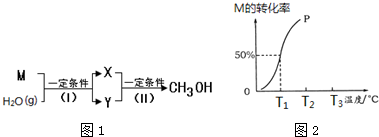
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com