
(本题共14分)X、Y、Z、W为短周期的主族元素,其原子序数依次增大。X元素形成的单质是自然界中含量最多的气体。Y是电负性最大的元素。W的原子最外层电子数与核外电子总数之比为3∶8。X的原子序数是Z的原子序数的一半。U原子基态的外围电子排布为3d104s1。
(1)Z基态的核外电子排布式 ,U在周期表中位置为 。
(2)在Y的氧化物OY2中,氧原子的杂化轨道类型是 。
(3)在银氨溶液中通入W的气态氢化物,会出现黑色沉淀,该反应的离子方程式是 。
(4)1molX的气态氢化物在800~900℃下催化氧化放出226.25KJ热量。该反应的热化学方程式为 _ 。
(5)U的含氧化合物M晶胞如右图所示(“○”表示氧原子),则M的化学式为 ;氧原子的配位数为 。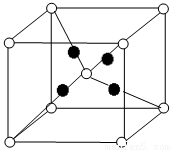
(1)1s22s22p63s23p2 ;第四周期IB族(各2分,共4分) (2)sp3 (2分)
(3)2Ag(NH3)2+ + 2OH- + H2S = Ag2S↓ + 2H2O + 4NH3(2分)
(4)4NH3(g) +5O2(g) =4NO(g)+ 6H2O(g) △H=-905kJ/mol(方程式正确1分,热量正确1分,共2分) (5)Cu2O; 4 (各2分,共4分)
【解析】
试题分析:X、Y、Z、W为短周期的主族元素,其原子序数依次增大。X元素形成的单质是自然界中含量最多的气体,因此X是氮元素。Y是电负性最大的元素,则Y是氟元素。W的原子最外层电子数与核外电子总数之比为3∶8,且W是四种短周期元素中原子序数最大的,因此W是第三周期元素,则W是硫元素。X的原子序数是Z的原子序数的一半,即Z的原子序数是14,因此Z是硅元素。U原子基态的外围电子排布为3d104s1,则U的原子序数是29,即为铜元素。
(1)根据原子核外电子排布规律可知硅元素基态的核外电子排布式为1s22s22p63s23p2,铜元素在周期表中位置为第四周期IB族。
(2)在Y的氧化物OF2中,氧原子含有的孤电子对数=(6-2×1)÷2=2,即氧原子的价层电子对数是4,所以氧原子的杂化轨道类型是sp3。
(3)在银氨溶液中通入W的气态氢化物硫化氢,会出现黑色沉淀,该沉淀应该是硫化银,因此反应的离子方程式是2Ag(NH3)2+ + 2OH- + H2S = Ag2S↓ + 2H2O + 4NH3。
(4)氨气催化氧化生成NO和水,若1molX的气态氢化物在800~900℃下催化氧化放出226.25KJ热量,则该反应的热化学方程式为4NH3(g) +5O2(g) =4NO(g)+ 6H2O(g) △H=-905kJ/mol。
(5)根据晶胞结构可知,晶胞中含有铜原子的数是4个,而氧原子数是1+8×1/8=2,所以M的化学式为Cu2O;根据晶胞结构可知氧原子周围距离最近的铜原子个数是4个,所以氧原子的配位数为4。
考点:考查元素推断、核外电子排布、杂化轨道、晶体结构及其有关计算等


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源:2013-2014天津市东丽区第一学期期末质量监测高一年级化学试卷(解析版) 题型:选择题
下列各组中的离子,能在溶液中大量共存的是
A.Ba2+、Na+ 、Cl-、SO42- B.Ag+ 、Al3+ 、NO3- 、H+
C.Na+、HCO3-、Cl-、OH- D.K+ 、H+ 、SO42- 、OH-
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高一下学期期末考试化学试卷(解析版) 题型:选择题
下列说法错误的是
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.双原子单质分子中的共价键一定是非极性键
查看答案和解析>>
科目:高中化学 来源:2013-2014四川绵阳中学实验学校高考冲刺理综化学试卷(解析版) 题型:填空题
(14分)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol?L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的化学方程式为 。
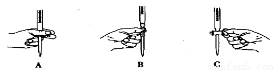
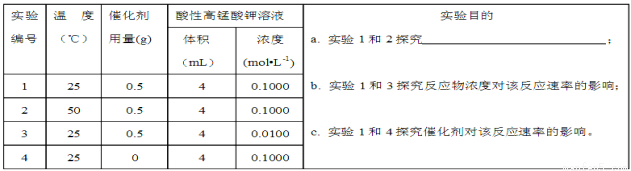
(2)滴定过程中操作滴定管的图示正确的是 。
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度 (填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
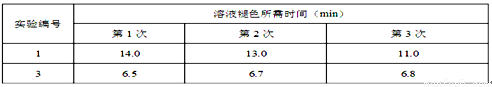
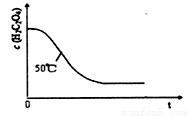
(4)写出表中a 对应的实验目的 ;若50°C时,草酸浓度c(H2C2O4)随反应时间t的变化曲线 如下图所示,保持其他条件不变,请在图中画出25°C时c(H2C2O4)随t的变化曲线示意图。
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述甲同学改进的实验方案 ______________________。
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因可用离子方程式表示为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川绵阳中学实验学校高考冲刺理综化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是 ( )
A.向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:
NH4++2Ba2++4OH-+Al3++2SO42- = 2BaSO4↓+Al(OH)3↓+ NH3.H2O
B.误将洁厕灵和“84”消毒液混合:2H++Cl-+ClO-=Cl2↑+H2O
C.向明矾溶液中加入少量的Ba(OH)2溶液:
2Al3++3SO42-+3Ba2++6OH- = 3BaSO4↓+2Al(OH)3↓
D.在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的离子方程式是:
3NH4++Fe3++3SO42-+3Ba2++6OH- = 3BaSO4↓+Fe(OH)3↓+3NH3.H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省雅安市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.Na2CO3溶液的水【解析】
CO32- + H3O+ HCO3-+H2O
HCO3-+H2O
B.钢铁吸氧腐蚀时,负极反应式为:4OH――4e-=2H2O+O2↑
C.向Al2(SO4)3溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀:
2Al3++3 SO42-+8OH—+3Ba2+=2AlO2-+ 3BaSO4↓+4H2O
D.氯化亚铁溶液中滴入稀硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:填空题
(12分)Ⅰ.(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 ________(填“促进”、“抑制”)其水解。
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
Ⅱ. 已知水在25 ℃(A)和T ℃(B)时,其电离平衡曲线如图所示:
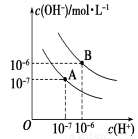
(1)25 ℃时,将pH=3 的H2SO4溶液与pH=10的NaOH溶液混合,若所得混合溶液的pH=7,则H2SO4溶液与NaOH溶液的体积比为 。
(2)T ℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强Ⅰ碱的pH2之间应满足的关系是 。
(3)曲线B对应温度下,pH=3的HCl溶液和pH=9的某碱溶液等体积混合后,混合溶液的pH>7。请分析其原因: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:选择题
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市高一下学期期末考试化学试卷(解析版) 题型:实验题
(5分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示的装置制取乙酸乙酯。回答下列问题:
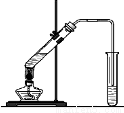
(1)写出制取乙酸乙酯的化学反应方程式:
______________________________________________________________
(2)饱和碳酸钠溶液的主要作用是_____________________________________________。
(3)若要把制得的乙酸乙酯分离出来,应采用的实验操作是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com