
【题目】钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
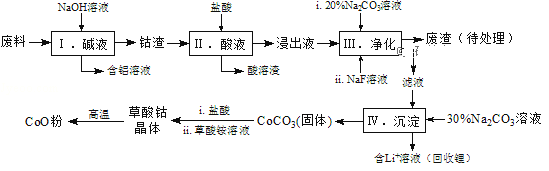
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是______.
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:______.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过______;废渣中的主要成分除了LiF外,还有______.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是______.
(5)在空气中加热5.49g草酸钴晶体(CoC2O42H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
①加热到210℃时,固体质量减轻的原因是______.
②经测定,加热到210~290℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:____.
【答案】2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑Co2O3+6H++2Cl﹣=2Co2++Cl2↑+3H2O7.15Fe(OH)3降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀失去结晶水3CoC2O4+2O2![]() Co3O4+6CO2
Co3O4+6CO2
【解析】
根据铝的性质写出铝与氢氧化钠溶液反应方程式;由已知Co2O3与盐酸反应生成Cl2知发生的是氧化还原反应,依据得失电子守进行配平;依据表中数据分析判断知道加入碳酸钠是调节溶液PH的;根据LiF难溶于水,Li2CO3微溶于水,加NaF将Li+生成LiF沉淀,降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀混入CoCO3。加热固体质量减轻的原因是失去结晶水。
步骤Ⅰ中铝与氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;答案:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑。
(2)Co2O3与盐酸反应生成Cl2,反应中钴元素化合价由+3价降低为+2价.氯元素化合价-1价变化为0价,依据得失电子守恒可知Co2O3的系数为1,Cl-的系数为2,结合原子个数守恒,反应的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;答案:Co2O3+6H++2Cl﹣=2Co2++Cl2↑+3H2O
(3)依据表中数据分析判断加入碳酸钠调节溶液使溶液PH增大,沉淀铁离子和锂离子,但不能沉淀钴离子,步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,故pH的取值范围是3.2≤pH<7.15;根据信息知LiF难溶于水,废渣中的主要成分为LiF和Fe(OH)3,所以答案为7.15 Fe(OH)3。
(4)因为LiF难溶于水,Li2CO3微溶于水。所以用NaF将Li+生成LiF沉淀,降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀混入CoCO3。
(5)①5.49 g 即0.03mol的CoC2O4·2H2O在150![]() 210℃时,质量减少=5.49-4.413=1.08g,即0.06mol的水,加热到210℃时,固体质量减轻的原因是失去结晶水。答案:失去了结晶水。
210℃时,质量减少=5.49-4.413=1.08g,即0.06mol的水,加热到210℃时,固体质量减轻的原因是失去结晶水。答案:失去了结晶水。
②加热到210~290℃过程中CoC2O4分解的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:3CoC2O4+2O2![]() Co3O4+6CO2。
Co3O4+6CO2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用四氯化碳萃取碘的饱和水溶液中的碘,下列说法中不正确的是
A.使用分液漏斗前要先检漏
B.碘在四氯化碳中的溶解度比在水中的溶解度小
C.碘的四氯化碳溶液在下层
D.分液时,碘的四氯化碳溶液从分液漏斗下口流出,水层从分液漏斗上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备氯气并进行一系列相关实验(夹持设备及必要的加热装置已省略)。
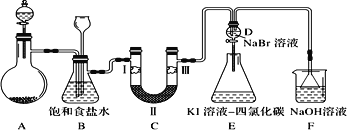
(1)整套装置装配完毕后,首先进行的操作是______________________,再添加试剂。
(2)实验室常用MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O制取氯气:
MnCl2+Cl2↑+2H2O制取氯气:
①实验时,通常采用密度为1.19g/cm3、浓度为36.5%的浓盐酸。该浓盐酸的物质的量浓度为___________________________。
②标准状况下,上述反应每生成4.48L氯气,转移电子的物质的量为_________ mol。
(3)洗气装置B的作用是除去Cl2中的HCl气体,同时用作安全瓶(监测实验时装置C中是否发生堵塞)。若装置C发生堵塞,装置B中将观察到的现象是_____________。
(4)装置C的作用是验证氯气是否具有漂白性。为此,实验时装置C中I、II、III处依次放入的物质是___________(填字母)。
A | B | C | D | |
I | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 无水氯化钙 | 无水氯化钙 | 浓硫酸 |
III | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(5)设计装置D、E的目的是比较氯、溴、碘的氧化性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为橙色,说明氯气的氧化性比溴单质的______(填“强”“或“弱”)。打开活塞,将装置D中少量溶液加入装置E中,振荡后静置,观察到的现象是___________。
(6)F为尾气吸收装置。实验时,该装置中反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中充入气体A和B,发生如下可逆反应:A(g) +B(g)![]() xC(g);△H = Q。在不同的温度和压强下,C在反应混合物中的含量随反应时间的变化如图所示。下列判断正确的是
xC(g);△H = Q。在不同的温度和压强下,C在反应混合物中的含量随反应时间的变化如图所示。下列判断正确的是

A. P1>P2,x=1 B. P1<P2,x≠1
C. T1<T2,Q>0 D. T1>T2,Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于NaHCO3的性质,下列说法正确的是
A. 热稳定性比Na2CO3大
B. 相同温度下溶解度比Na2CO3要大
C. NaHCO3只能和酸作用不能和碱作用
D. 和酸反应放出等量的CO2所消耗的酸比Na2CO3少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。下图所示是硫及其部分化合物的“价类二维图”, 根据图示回答下列问题:
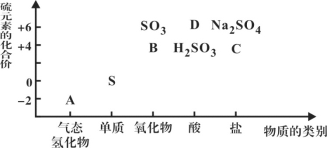
(1)图中A、B、C、D四种物质中,属于非电解质的是__________(用化学式表示)。
(2)足量B通入紫色石蕊溶液的现象是__________________________;
用一个化学方程式说明B具有还原性_____________________________。
(3)C在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,理论上其可被还原为__________(填标号)。
A.Na2S B.S C.H2SO3 D.Na2SO4 E.H2SO4
(4)将A与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为_____。
(5)D的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为_________________,反应中D显示酸性和______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2为V形的极性分子
B. ClO3-的空间构型为平面三角形
C. SF6中有6对完全相同的成键电子对
D. SiF4和SO32-的中心原子前者为sp3杂化,后者为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备:
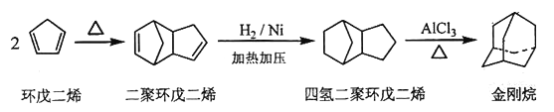
请回答下列问题:
(1)环戊二烯分子中最多有________个原子共平面;
(2)金刚烷的分子式为_____,其分子中的-CH2-基团有_____个;
(3)已知烯烃能发生如下反应:
 。
。
请写出下列反应产物的结构简式:
 ;_______
;_______
(4)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸[提示: 苯环上的烷基(-CH3,-CH2R,-CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基],写出A所有可能的结构简式(不考虑立体异构):_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com