
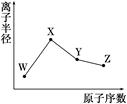
| A.化合物XZW既含离子键也含共价键 |
| B.对应气态氢化物的稳定性Y>Z |
| C.对应简单离子半径:X>W |
| D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应 |
科目:高中化学 来源:不详 题型:单选题
| A.第三、四周期同主族元素的原子序数相差8 |
| B.任何原子都是核外电子层数等于该元素在周期表中的周期数 |
| C.短周期中次外层电子数是最外层电子数2倍的元素一定是非金属元素 |
| D.短周期中族序数与周期数相同的元素是H、Be |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:Y>Z>R>T |
| B.气态氢化物的稳定性:W<R<T |
| C.最高价氧化物对应的水化物碱性:X>Z |
| D.XR2、WR2两化合物中R的化合价相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.以共价键形成的单质中只存在非极性键,以共价键形成的化合物中只存在极性键 |
| B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同 |
| C.PCl3和Na2O2中各原子或离子最外层都满足8电子稳定结构 |
| D.24Mg34S晶体中电子总数与中子总数之比为1∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 有关信息 |
| X | 原子半径为0.074 nm,其氢化物的结构模型可表示为: |
| Y | 原子半径为0.102 nm,其原子核外电子排布为: |
| Z | 人体中必需微量元素中含量最多,体内缺失会引起贫血 |
| W | 所在主族序数与所在周期序数之差为4 |
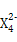 ,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。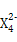 具有强氧化性,能杀菌消毒,还原产物是Z3+。
具有强氧化性,能杀菌消毒,还原产物是Z3+。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
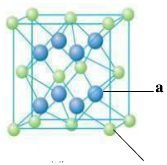
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
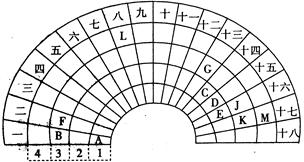
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | X | Y | Z | W |
| 原子半径/10-12 m | 160 | 110 | 70 | 66 |
| 主要化合价 | +2 | +5、+3、-3 | +5、+3、-3 | -2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com