
【题目】

(1)需要量取浓盐酸_________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外, 还必须用到的仪器有 、 。
(3)若实验遇到下列情况,所配溶液的浓度会(填“偏高”、“偏低”、“不变”)
A、定容时仰视刻度线_________;
B、容量瓶内壁附有水珠而未干燥处理______ ;
C、溶解后没有冷却便进行定容_____ 。
(4)将所配制的稀盐酸倒入5.92g Na2CO3和NaHCO3的固体混合物中,恰好完全反应,则原混合物中Na2CO3的质量分数为 。
【答案】(1)8.5
(2)胶头滴管 250mL容量瓶
(3)偏低 不变 偏高
(4)71.6%
【解析】试题分析:(1)根据标签所示可知,该浓盐酸的物质的量浓度为c=![]() =
=![]() =11.8mol/L。需配制250mL 0.4mol/L的稀盐酸,根据稀释公式,c1V1=c2V2,则有:11.8mol/L×V1="250mL" 0.4mol/L×250mL,求解得V1=8.5mL。
=11.8mol/L。需配制250mL 0.4mol/L的稀盐酸,根据稀释公式,c1V1=c2V2,则有:11.8mol/L×V1="250mL" 0.4mol/L×250mL,求解得V1=8.5mL。
(2)操作步骤有计算、量取、稀释、移液、洗涤、定容、摇匀等操作,用10mL量筒量取(用到胶头滴管)浓盐酸,在烧杯中稀释,用玻璃棒搅拌,冷却至室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀,需要的仪器为:玻璃棒、烧杯、胶头滴管、10 mL量筒、250mL容量瓶,故答案为:胶头滴管;250mL容量瓶;
(3)A、定容时仰视刻度线,使溶液体积偏小,导致所配制溶液浓度偏大;B、容量瓶内壁附有水珠而未干燥处理,不影响配制结果;C、溶解后没有冷却便进行定容,导致冷却后溶液体积减小,配制的溶液浓度偏大。
(4)将所配制的稀盐酸物质的量为0.4mol/L×250mL=0.1mol,倒入5.92g Na2CO3和NaHCO3的固体混合物中,恰好完全反应。设Na2CO3物质的量为xmol,NaHCO3物质的量为ymol,则有:2x+y=0.1,106x+84y=5.92。x=0.04mol,y=0.02mol。则原混合物中Na2CO3的质量分数为![]() ×100%=71.6%。
×100%=71.6%。


科目:高中化学 来源: 题型:
【题目】下列各组离子:
(1)I-、Fe2+、NO3-、H+
(2)K+、NH4+、HCO3-、OH-
(3) MnO4-、H+、K+、Cl-
(4)Fe2+、Cu2+、SO42-、Cl-
(5) Na+、K+、Al3+、HCO3-
(6) 加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I-
(7)室温下 ![]() 溶液中:Fe2+、NH4+、SO32-、Cl-
溶液中:Fe2+、NH4+、SO32-、Cl-
(8) 0.2 mol/L的NaNO3溶液:H+、Fe2+、SO42-、Cl-
在澄清透明溶液中能大量共存的组别共有
A.1组 B.2组 C.3组 D.不少于4组
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料。Z的非金属性在同周期元素中最强。下列说法正确的是

A. 对应简单离子半径:X>W
B. 对应气态氢化物的稳定性:Y>Z
C. 化合物XZW既含离子键,又含共价键,属于弱电解质
D. Y的氧化物和Z的氢化物均能与X的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们获得食盐的方式有多种,最主要的是海水晒盐。通过海水晾晒得到的粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,以下是制备精盐的实验流程(试剂以化学式表示)
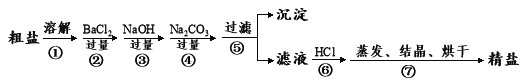
(1)BaCl2、NaOH、Na2CO3的加入顺序,必须保证___________在____________后
(2)溶解、过滤、蒸发过程中都使用到的玻璃仪器是_______ _________,蒸发时玻璃棒的作用是______________________
(3)经过⑤步骤之后得到的沉淀的成分为:________________________
(4)制得的精盐中不小心混入了硝酸钾晶体,用电子天平称取8.00g样品溶于水,向溶液中加入足量硝酸银溶液,将产生的沉淀过滤、洗涤、干燥,并称得其质量为14.35g,则该样品中氯化钠的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛对人体无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关48Ti和50Ti的说法正确的是( )
A. 48Ti和50Ti的质子数相同,是同一种核素
B. 48Ti和50Ti的质量数不同,属于两种元素
C. 48Ti和50Ti的质子数相同,互称同位素
D. 48Ti和50Ti的质子数相同,中子数不同,互称同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国自古有“信口雌黄”、“雄黄入药”之说。雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。根据题意完成下列填空:
(1) 砷元素有+2、+3两种常见价态。As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,写出该反应的化学方程式_____________________。
(2) 上述反应中的氧化剂是___________;氧化产物是___________;反应产生的H2S气体可用____________吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++ 10NO3—=2H3AsO4+3S+10NO2↑+ 2H2O。若生成1mol H3AsO4,则反应中转移电子的物质的量为___________;若将该反应设计成一原电池,则NO2应该在___________(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2LO2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,写出碳与浓硝酸反应的化学方程式__________________;所产生的CO2的量___________(选填编号)。
A.小于0.5mol B.等于0.5mol C.大于0.5mol D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的性质比较,正确的是( )
A. 酸性:H2SO4﹤HClO B. 气态氢化物稳定性:HCl>H2S
C. 离子半径:Na+>F- D. 碱性:NaOH>KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醛在有机合成中十分重要,已知如下反应:
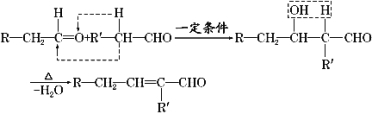
由枯茗醛合成兔耳草醛的传统合成路线如图所示:
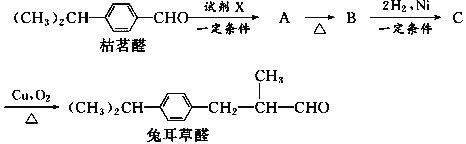
(1)写出试剂X的结构简式:__________________。
(2)写出有机物B的结构简式:__________________________。
(3)写出有机物C →兔耳草醛的化学方程式:________________________。
(4)人们最新研究的兔耳草醛的合成路线,该路线原子利用率理论上可达100%:

试写出D的结构简式:_________________________。
(5)芳香族化合物Y与枯茗醛互为同分异构体,Y具有如下特征:
a.不能发生银镜反应,可发生消去反应;
b.核磁共振氢谱显示:Y消去反应产物的环上只存在一种化学环境的氢原子。写出Y所有可能的结构简式:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com