
【题目】(1)盐酸中加入六次甲基四胺对钢铁有一定缓蚀作用,右图为其结构简式,其分子式为(CH2)6N4,其中碳原子采用___________杂化,其缓蚀作用是因为分子中___________原子的孤对电子能与铁原子形成配位键,覆盖在钢铁表面。

(2)CO与N2属于等电子体,1个CO分子中含有的π键数目是___________个。
C、N、O三种元素的笫一电离能最大的是___________。
(3)右图是某化合物的晶胞示意图,硅原子与铝原子之间都以共价键连接。

①该化合物的化学式是___________。
②Si元素基态原子的电子排布式是___________。
③已知晶胞边长为5.93×10-8cm,Si与A1之间的共价键键长是___________cm(只要求列算式,不必计算出数值,下同),晶体的密度是___________g·cm-3
【答案】 sp3杂化 氮 2 N LiAlSi 1s22s22p63s23p2 ![]() ×5.93×10-8/4
×5.93×10-8/4 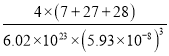
【解析】(1)根据结构简式可知分子中碳原子全部形成单键,碳原子采用sp3杂化杂化。氮原子含有孤对电子,所以其缓蚀作用是因为分子中氮原子的孤对电子能与铁原子形成配位键,覆盖在钢铁表面。(2)CO与N2属于等电子体,结构相似,则1个CO分子中含有的π键数目是2个。非金属性越强,第一电离能越大,但氮元素的2p轨道电子处于半充满状态,稳定性强,则
C、N、O三种元素的笫一电离能最大的是N。(3)①根据晶胞结构可知Si原子个数是4,Al原子个数是8×1/8+6×1/2=4,Li原子个数是12×1/4+1=4,因此该化合物的化学式是LiAlSi。②Si元素的核外电子数是14,基态原子的电子排布式是1s22s22p63s23p2。③已知晶胞边长为5.93×10-8cm,则其体对角线是![]() 。Si与A1之间的共价键键长是对角线的1/4,即为
。Si与A1之间的共价键键长是对角线的1/4,即为![]() 。晶体的密度是
。晶体的密度是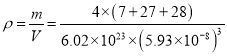 g·cm-3。
g·cm-3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】1,4-二苯基丁烷是用来研究聚合物溶剂体系热力学性质的重要物质,工业上用下列方法制备1, 4-二苯基丁烷。(格拉泽反应:2R-C≡C-H![]() R-C≡C-C≡C-R+H2)
R-C≡C-C≡C-R+H2)

回答下列问题:
(1)②和⑤的反应类型分别为__________________、____________。
(2)反应③由C生成D的条件是_____________________。
(3)E的结构简式为___________,该分子中位于同一直线上的原子最多是___________个。
(4)反应①的化学方程式是___________。
(5)C与足量氢氧化钠水溶液反应可制得化合物F,F的分子式是__________,同时符合下列条件的F的同分异构体有_____________种(不含立体异构)。
①1mol该异构体最多能与2mol NaOH溶液反应
②该异构体的核磁共振氢谱显示为3组峰,且峰面枳之比为1:1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A. 烧杯中有铜无铁 B. 烧杯中有铁无铜
C. 烧杯中铁、铜都有 D. 烧杯中铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素。A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol·L-1D溶液的pH为1。在一定条件下它们之间的相互转化关系如图所示。下列说法正确的是( )

A. X、Y、Z元素的离子半径大小是X>Y>Z
B. X元素的氢化物沸点比同主族元素的氢化物低
C. Y与Q和W与Q元素形成的化合物化学键类型相同
D. Q的最高价氧化物对应的水化物和氢化物的酸性在同主族元素中是最强的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁带在盐酸中反成,产生H2的速率(v)与时间(t)的关系如下图所示。
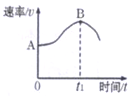
(1)写出该反应的离子方程式____________________。
(2)下列变化:①H+的浓度②镁带的表面积③溶液的温度④Cl-的浓度,不能影响该反应速率的有_________(填写选项的序号)。
(3)0~t1,时间段速率逐渐加快的主要原因是___________。
(4)t1时刻后反应速率变慢的主要原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3经一系列反应可以得到HNO3,如下图所示。

(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是____________。
(2)II中,2NO(g)+O2(g)![]() 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如下图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如下图)。

①比较P1、P2的大小关系:P1______P2(用“>”、“<”、“=”)
②随温度升高,该反应平衡常数变化的趋势是________。
(3)III中,将NO2、O2、H2O化合制硝酸的化学方程式_______。
(4)IV中,电解NO制备 NH4NO3,其工作原理如下图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____________,说明理由:________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示水中c(H+)和c(OH-)的关系。下列判断正确的是

A. 图中T1>T2
B. XZ线上任意点均有pH<7
C. 两条曲线间任意点均有c(H+)×c(OH+)=Kw=1×10-13
D. M区域内任意点对应的溶液中下列离子均可大量共存:S2-、SO42-、Na+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 40K与40Ca原子中的中子数相等
B. 互为同位素的两种原子,它们原子核内的质子数一定相等
C. 人们发现了112种元素,即共有112种原子
D. 原子结构模型演变历史可以表示为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com