
| A. | 检验CH3CH2Cl碱性水解产生的Cl-,先要用稀硫酸酸化,再检验 | |
| B. | KMnO4溶液通常可用盐酸酸化,以增强氧化性 | |
| C. | 配置Fe(NO3)2溶液时,用硝酸酸化,可抑制水解 | |
| D. | 鉴别溶液中是否有SO42-,先用盐酸酸化,再加BaCl2溶液 |
科目:高中化学 来源: 题型:选择题
| A. | 若反应从正方向开始,X、Y的转化率可能不相等 | |
| B. | C1:C2=1:3 | |
| C. | 平衡时,X和Z的生成速率之比为1:2 | |
| D. | C2的取值范围为0<C2<0.84 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:Fe2+>Fe3+ | |
| B. | 酸性:HClO4>H2SO4>H2SeO4 | |
| C. | 反应活泼性:O>03>02 | |
| D. | 物质的量浓度:pH相等时,CH3C00H>HCl0. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH5+中含有的电子数目为11NA | |
| B. | 0.1mol/L AlCl3溶液中含有的Al3+数目一定小于0.1NA | |
| C. | 78gNa2O2和Na2S的混合物中含有的阴离子数目一定是NA | |
| D. | 常温下,1L PH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
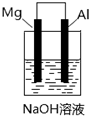
| A. | 该装置中镁条作负极 | |
| B. | 该装置中镁条上无气泡产生 | |
| C. | 该装置中电子从铝条经导线流向镁条 | |
| D. | 该装置中铝条表面产生气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )
如图所示,m表示溶液中生成沉淀的物质的量,n表示溶液中加入物质的量.下列反应中,能按照如图曲线进行的是( )| A. | 往Ca(OH)2和KOH的混合溶液中通入CO2 | |
| B. | 往AlCl3和NH4Cl的混合溶液中加NaOH溶液 | |
| C. | 往Al2(SO4)3和(NH4)2SO4的混合溶液中加Ba(OH)2溶液 | |
| D. | 往NH4Al(SO4)2溶液中加入NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH2=CH2和HCHO都能使溴水褪色 | |
| B. | CH4和苯都能够和氯单质发生反应 | |
| C. | 卤代烃与氢氧化钠水溶液或醇溶液发生反应 | |
| D. | 二氧化硫能使溴水或者酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
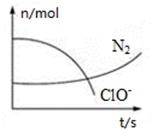 某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO-和N2的物质的量随时间的变化如图所示.有关判断正确的是( )
某反应体系中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种微粒,反应过程中测得ClO-和N2的物质的量随时间的变化如图所示.有关判断正确的是( )| A. | 氧化剂是ClO-,还原产物是HCO3- | |
| B. | 反应体系中反应物与生成物各有三种微粒 | |
| C. | 氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 生成2.24L N2(标准状况)时转移电子0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当滴入20mL NaOH溶液时:2c(SO42-)=c(NH3•H2O)+c(NH4+) | |
| B. | 当滴入30mL NaOH溶液时(pH>7):c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | 当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) | |
| D. | 整个反应过程中:c(H+)+c(Na+)+c(NH4+)=c(OH-)+2c(SO42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com