
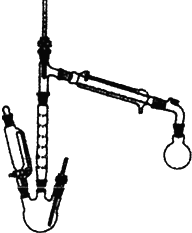
 实验室也可用如图所示的装置制取少量乙酸乙酯.(已知乙酸乙酯在水中的溶解度较大,15℃时100g水中能溶解8.5g)
实验室也可用如图所示的装置制取少量乙酸乙酯.(已知乙酸乙酯在水中的溶解度较大,15℃时100g水中能溶解8.5g)分析 (1)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强;
(2)依据温度对速率的影响结合乙醇与乙酸在浓硫酸做催化剂、脱水剂条件下生成乙醚解答;
(3)乙醇蒸发吸收大量的热,降低温度反应速率减慢.
解答 解:(1)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;
故答案为:便于乙醇和冰醋酸的混合液顺利流下;
(2)升高温度可以加快反应速率,乙醇与乙酸在浓硫酸做催化剂、脱水剂条件下生成乙醚,所以在实验中控制三颈烧瓶中反应温度在120℃左右目的是:温度过低,反应速度较慢;温度过高,发生副反应生成乙醚等;
故答案为:温度过低,反应速度较慢;温度过高,发生副反应生成乙醚等;
(3)滴加混合液时若速度过快,会使大量乙醇来不及反应而被蒸出,同时也造成反应混合物温度下降,导致反应速度减慢;
故答案为:反应混合物温度下降;
点评 本题考查了乙酸乙酯的制备,明确制备原理及反应物生成物的性质是解题关键,注意温度对速率的影响,题目难度中等.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
发射“嫦娥一号”月球探测卫星的长征三号甲运载火箭的第三级使用的燃料是液氢和液氧,已知下列热化学方程式:①H2(g)+1/2O2(g)==H2O(l)ΔH1=-285.8kJ/mol
②H2(g)==H2(l)ΔH2=-0.92kJ/mol,③O2(g)==O2(l)ΔH3=-6.84kJ/mol
④H2O(l)==H2O(g)ΔH4=+44.0kJ/mol则反应H2(l)+1/2O2(l)==H2O(g)的反应热ΔH为
A.+237.46kJ/mol B.-474.92kJ/mol C.-118.73kJ/mol D.-237.46kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
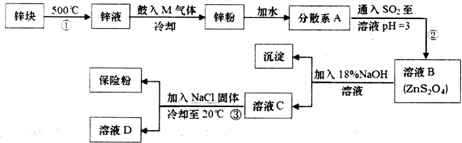
 .分散系A为悬浊液(填“溶液”“胶体”或“悬浊液”).
.分散系A为悬浊液(填“溶液”“胶体”或“悬浊液”).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
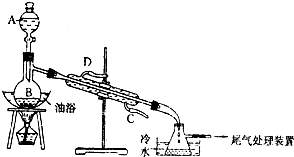 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有无水乙醇和冰醋酸.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有无水乙醇和冰醋酸.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
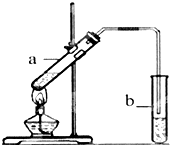 葡萄可用于酿酒.
葡萄可用于酿酒.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
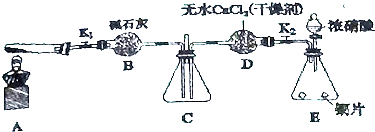
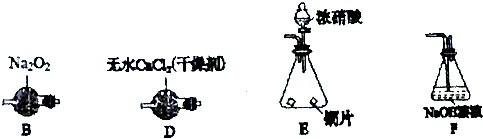
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
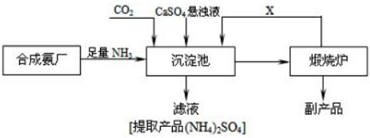
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com