
【题目】短周期主族元素X、Y、Z、W的原子序数依次 增大。在如图所示的物质转化关系中,p、q、 m.n分别是元素W、X、Y、Z的气体单质,p和 s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol L -1 ,t 溶液与 0.1 mol L -1 u 溶液的pH均为1。下列说法不正确的是
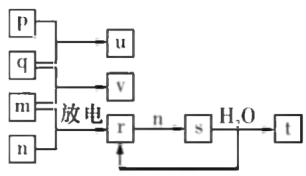
A.Y、W的兹高价氧化物对应的水化物均为强酸
B.元索的非金属性:Z>Y>X;原子半径:X<Z<Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.的电子式可表示为![]()
【答案】D
【解析】
短周期主族元素X、Y、Z、W的原子序数依次增大.由图中物质转化关系及p和s均为有色气体,v的水溶液呈碱性.常温下,0.1molL-1t溶液与0.1molL-1u溶液的pH均为1,v为NH3,p为Cl2,u为HCl,q为H2,m为N2,n为O2,r为NO,s为NO2,t为HNO3,p、s分别为黄绿色、红棕色;又p、q、m、n分别是元素W、X、Y、Z的气体单质,则X为H,Y为N,Z为O,W为Cl;
由题意分析可知,X为H,Y为N,Z为O,W为Cl,
A.Y、W的最高价氧化物对应的水化物分别为硝酸、高氯酸,均为强酸,故A正确;
B.O只有负价,高氯酸的酸性大于硝酸,则元素的非金属性:Z>Y>X,电子层越多原子半径越大、同周期从左向右原子半径减小,则原子半径:X<Z<Y,故B正确;
C.s为NO2,与水反应生成硝酸和NO,s为氧化剂、还原剂,结合元素的化合价变化可知,氧化剂与还原剂的物质的量之比为1:2,故C正确;
D.v为NH3,其电子式为![]() ,故D错误;
,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】某中性有机物A的分子量为88,碳的质量分数为54.5%,氢的质量分数为9.1%,其余为氧。可发生如图所示变化:
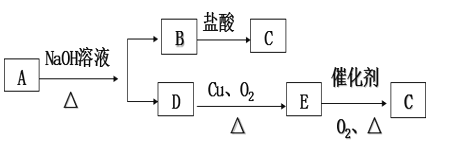
(1)C中官能团的名称是__________ 。
(2)D→E的反应类型是____________。
(3)有机物A与氢氧化钠溶液反应的化学方程式为___________。
(4)已知某烃X的相对分子质量比A小16,分子中碳与氢的质量之比为5:1。下列说法正确的是________。
A.相同条件下X的密度比水小
B. 烃X能与氢气发生还原反应
C.甲烷与烃X互为同系物
D.C、D、E可用新制氢氧化铜检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如图。

请回答下列问题:
Ⅰ.转化脱硫:将天然气压入吸收塔,30℃时,在T·F菌作用下,酸性环境中脱硫过程示意图如图。
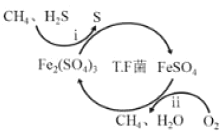
过程i的离子反应方程式为_____。
已知:①Fe3+在pH=1.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T·F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速率 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在表中选择最佳pH范围是____<pH<____,这样选择的原因是:______。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合如图回答问题。
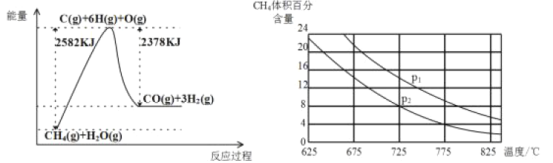
(3)①该过程的热化学方程式是_____。
②比较压强P1和P2的大小关系:P1____P2(选填“<”、“>”或“=”)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.提纯:将CO2和H2分离得到H2的过程如示意图如图。
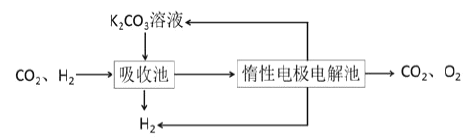
(4)吸收池中发生反应的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液。除烧杯和玻璃棒外,还需要的玻璃仪器有______;
(2)选择酚酞为指示剂进行滴定:
①盛装0.1000mol/L的盐酸标准液应该使用_____式滴定管;
②滴定时双眼应_______________;
③滴定终点的实验现象:___________。
(3)有关数据记录如下:
测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
滴定前读数 | 滴定后读数 | ||
① | 20.00 | 0.50 | 20.78 |
② | 20.00 | 1.20 | 21.32 |
计算纯度:烧碱样品的纯度是________;(取两次实验所耗盐酸的平均值进行计算)
(4)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,会使测定结果__________;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,会使测定结果_______;
③读数时,滴定前仰视,滴定后俯视,会使测定结果__________;
④装标准液之前,没有用标准液润洗滴定管,会使测定结果__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用序号填写下列空格:
①O2和O3②H2、D2和T2③12C和14C④石墨和足球烯(C60)⑤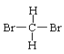 和
和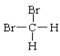 ⑥正丁烷和异丁烷⑦
⑥正丁烷和异丁烷⑦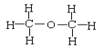 和
和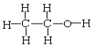 ⑧CH3CH3和CH3CH2CH2CH3
⑧CH3CH3和CH3CH2CH2CH3
互为同素异形体的是___;互为同位素的是__,互为同分异构体的是__,互为同系物的是__,同一种物质的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素①~⑩在周期表中的位置如表所示,试回答下列问题。
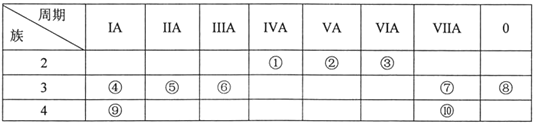
(1)上述10种元素中,化学性质最不活泼的是___(填元素符号,下同);与水反应最激烈的金属元素是___。
(2)元素①最高价氧化物的结构式是___;元素②的简单气态氢化物的电子式是___;上述10种元素中,其最高价氧化物对应水化物的酸性最强的物质是___(填化学式)。
(3)①②⑤元素的原子半径由小到大的顺序为___(用元素符号表示);
(4)请用一个化学方程式(或离子方程式)说明元素⑦和⑩非金属性的强弱:___。
(5)④和⑥两元素的最高价氧化物对应的水化物相互反应的离子方程式:___。
(6)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是___。
A.比较两种元素的单质的熔点、沸点高低
B.将打磨过的形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
C.比较两种元素的最高价氧化物对应的水化物碱性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 植物油的主要成分是高级脂肪酸
B. 异丙苯(![]() )中碳原子可能处于同一平面上
)中碳原子可能处于同一平面上
C. 某些蛋白质可溶于溶剂形成分子胶体,但遇乙醇发生变性
D. 分子式为C4H10O并能与金属钠反应的有机物有5种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-57.3kJ/mol
B. KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol
K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol
C. C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(g) ΔH=-5518kJ/mol
O2(g)=8CO2(g)+9H2O(g) ΔH=-5518kJ/mol
D. 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1) ΔH=-5518kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某元素的价类二维图。其中X是一种强碱,G为正盐,通常条件下Z是无色液体,C的相对分子质量比D大16,各物质转化关系如图所示。下列说法正确的是
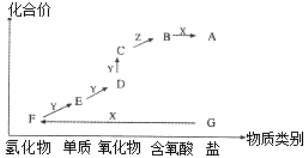
A.A的水溶液显碱性
B.D为一种红棕色气体
C.B 和F能发生复分解反应生成盐
D.F在一定条件下可直接与Y反应生成D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com